将0.1 mol的镁、铝混合物溶于100 mL,2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH 溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160 mL时,则金属粉末中n(Mg)=____________mol,n(Al)=____________mol,V2=____________mL。

(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____mL。
(3)若混合物仍为0.1 mol,其中镁粉的物质的量分数为a ,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
完成下列填空:
(1)氯碱工业主要以食盐为原料。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是。
①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液
a.②⑤④①③ b.①④②⑤③ c d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是。
(4)步骤II反应的离子方程式__________________________________________。
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产 ,请解释原因。
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你_______(选填“同意”,“不同意”)该说法,理由是。
铁是最常见的金属之一,铁可以形成多种氧化物、氢氧化物和盐类。铁与二氧化碳、水在某一密闭体系中反应情况如下表所示:
| 化学反应 |
平衡 常数 |
温度 |
|
| 973K |
1173K |
||
①Fe(s)+CO2(g)  FeO(s)+CO(g) FeO(s)+CO(g) |
K1 |
1.47 |
2.15 |
②Fe(s)+H2O(g)  FeO(s)+H2(g) FeO(s)+H2(g) |
K2 |
2.38 |
1.67 |
③CO(g)+ H2O(g)  CO2(g)+ H2(g) CO2(g)+ H2(g) |
K3 |
? |
? |
完成下列填空:
(1)反应①是(选填“吸热”,“放热”)反应。根据反应①与②可以推导出同温下K1、K2与K3之间的关系,则K3=(用K1、K2表示)。
(2)973K时,若反应③在一个容积为2L的反应容器内2min时达到平衡,有3mol电子发生转移,则在2min内v(CO2)= 。若压缩容器的容积为原来的一半,平衡将移动(选填“向左”,“向右”,“不”),CO2的浓度将(选填“增大”,“减小”,“不变”)。使该反应的平衡转化率及平衡常数都增大的措施有。
(3)在FeCl3稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是;若在其中加入少量KCl固体,溶液的颜色________(选填“变深”,“变浅”,“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加KSCN溶液,则不呈红色,若再加入足够量FeCl3溶液.又会呈现红色。请对上述实验现象作出解释。
磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为 ),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),三聚磷酸钠(俗称“五钠”)是常用的水处理剂,次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
(1)磷元素原子核外最外层电子排布式为。NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为。
(2)氧原子核外有种不同能量的电子。
(3)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式。
(4)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。
(5)三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构式为。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为____________。
(6)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+→__Ni + ___H2PO3-+ 。请完成并配平上述反应离子方程式。该反应的还原产物是__________。
天然碱的组成可以用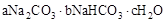 (a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
(a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
将质量为31.0 g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 2.24 L(标准状况)和水5.4 g。
(1)天然碱A的化学式中:

已知:Na2CO3与稀盐酸的反应分下列两步进行:
Na2CO3+HCl NaCl+NaHCO3 NaHCO3+HCl
NaCl+NaHCO3 NaHCO3+HCl NaCl+CO2↑+H2O
NaCl+CO2↑+H2O
将质量为12.45 g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐
酸的体积(标准状况)的关系如下表所示:
| 盐酸体积(mL) |
20 |
40 |
60 |
80 |
| 产生气体体积(mL) |
0 |
560 |
1680 |
2520 |
(2)由表中数据可推测加入50mL盐酸时,产生气体的体积为 mL(标准状况);盐酸的浓度为 mol/L;天然碱B的化学式为: 。
(3)若取一定质量的天然碱B加入到30mL该浓度的盐酸中,请写出产生气体体积V(mL,标准状况)与天然碱B质量W(g) 之间的关系式。
卤代烃(R-X)在醚类溶剂中与Mg反应可制得格氏试剂,格氏试剂在有机合成方面用途广泛。
已知: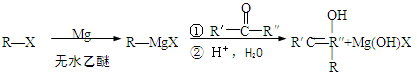
(R表示烃基,R′和R″表示烃基或氢)
某有机物A有如下转化: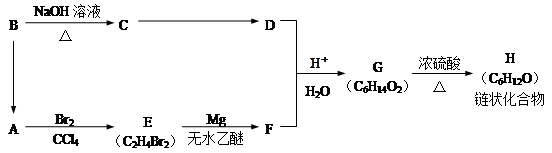
试回答下列问题:
(1)B→A的反应条件为__________________________,B→C的反应类型是_______________。
(2)G的结构简式是_______________________________。
(3)H中所含官能团的名称是________________________________________。
(4)写出一种满足下列条件的物质H的同分异构体的结构简式 ____________________________
①能发生银镜反应;②有三种不同氢原子;③含有最多的甲基
(5)聚苯乙烯(PS)由苯乙烯( )聚合而成,是一种多功能塑料,广泛应用于食品包装,机器设备等许多日常生活领域中。写出以 D和苯为主要原料制备苯乙烯(
)聚合而成,是一种多功能塑料,广泛应用于食品包装,机器设备等许多日常生活领域中。写出以 D和苯为主要原料制备苯乙烯( )的合成路线流程图,无机试剂任选。
)的合成路线流程图,无机试剂任选。
(合成路线常用表示方法为:A B ……
B …… 目标产物)
目标产物)