如图所示,在不同的电解质溶液中可以组成不同的电池。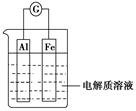
(1)①当电解质溶液为稀硫酸时,Fe电极是 (填“正”或“负”)极,其电极反应式为
。
②当电解质溶液为NaOH溶液时,Al电极是 (填“正”或“负”)极,其电极反应式为 。
(2)若把铝改为锌,电解质溶液为浓硝酸,则Fe电极是 (填“正”或“负”)极,其电极反应式为 。
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。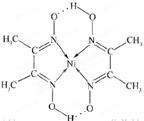
(2)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(4)某配合物的分子结构如图所示,其分子内不含有 (填字母)。
A.离子键 B.共价键 C.配位键 D.氢键
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其他产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是_________________。
(2)在方法二中,阳极生成磷酸亚铁锂的电极反应式为________________。
(3)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
为建设美丽浙江,浙江省政府开展“五水共治”。
(1)城市饮用水处理时可用二氧化氯(ClO2)替代传统的净水剂Cl2。工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:_______________。
(2)某地污水中的有机污染物主要成分是三氯乙烯 (C2HCl3),向此污水中加入KMnO4(高锰酸钾的还原产物为MnO2)溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出该反应的化学方程式_________________。
按下列要求填空:
(1)写出过氧化氢和过氧化钠的电子式: 、 。
(2)已知叠氮酸(HN3)是与醋酸酸性相近的酸。写出其在水溶液中电离的方程式: 。
(3)已知水溶液中,YO3n-和3S2-发生反应,离子方程式如下:YO3n-+3S2-+6H+=Y-+3S↓+3H2O,则微粒YO3n-所带的电荷为 。
(4)写出钢铁吸氧腐蚀中正极的电极反应式: 。
(5)在标准状况下,1L水中能溶解a L氯化氢气体,所得溶液密度为ρg/cm3 。请计算出氢化氢的物质的量浓度(要求化简) 。
盐酸多利卡因是一种局麻药及抗心律失常药,可由芳香烃A为起始原料合成:
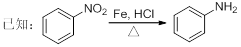
回答下列问题:
(1)B的官能团名称为____________,D的分子式为____________。
(2)反应①的化学方程式为_______________________,反应类型为____________,上述流程中,反应类型与①相同的还有____________(填反应序号)。
(3)反应④除了生成E外,另一种产物的化学式为____________。
(4)写出ClCH2COCl 与足量的NaOH溶液反应的化学方程式_______________________。
已知: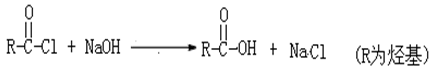
(5)C的芳香族同分异构体中,苯环上只有一个取代基的异构体共有________种(不考虑立体异构),其中核磁共振氢谱共有四个峰,且峰面积比为6:2:2:1的是______(写结构简式)。