(1)已知298K时,Fe(OH)3的溶度积常数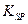 =2.6×10-39,Mg(OH)2的溶度积常数
=2.6×10-39,Mg(OH)2的溶度积常数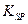 =5.6×
=5.6×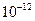 ,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
有没有Mg(OH)2沉淀生成______________填“有”或“无”),理由是________________________________。
(2)酸HnA与碱B(OH)m完全反应生成正盐.
①若HnA为HCl,且该盐溶液的pH<7,用离子方程式说明原因:
②若将0.4mol·L-1的NaOH溶液与0.2mol·L-1的HnA溶液等体积混合后pH=10,
则HnA为 (填序号).
a.一元强酸 b. 一元弱酸 c. 二元强酸 d. 二元弱酸
(3)某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题: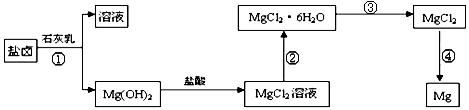
ⅰ.从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2。
ⅱ .过程③的转化需要在HCl气流中加热,HCl的作用是
.过程③的转化需要在HCl气流中加热,HCl的作用是
ⅲ.写出过程④中发生反应的化学方程式
化合物IV为一种重要化工中间体,其合成方法如下: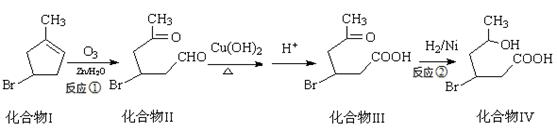
(1)化合物I的化学式为。
(2)化合物Ⅱ具有卤代烃的性质,在一定条件下能生成烯,该反应条件是。
(3)1mol化合物III与足量NaOH反应消耗NaOH的物质的量为mol。
(4)化合物IV能发生酯化反应生成六元环化合物V,写出该反应的化学方程式
。
(5) 异黄樟油素( 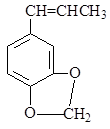 )发生类似反应①的反应,得到一种环状化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为______________________。
)发生类似反应①的反应,得到一种环状化合物Ⅵ(一种香料),化合物Ⅵ的结构简式为______________________。
维生素C的结构如右,它是人体维持正常生命过程所必需的一类有机物,主要来源于新鲜的蔬菜和水果中。请回答以下关于维生素C的问题。
(1)维生素C的类别是(填序号)。
A.芳香族化合物 B.酚类化合物 C.醛类化合物 D.酯类化合物
(2)请写出维生素C的含氧官能团的名称 。
(3)关于维生素C说法正确的是(填序号)。
A.在一定条件下,能发生取代反应、加成反应、消去反应和氧化反应
B.能使FeCl3溶液呈紫色
C.能使酸性KMnO4溶液褪色
D.1mol维生素C能与2molH2反应
常见的纽扣式电池为银锌电池。它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极壳一端填充由Ag2O和少量石墨组成的正极活性材料,负极盖一端填充锌汞合金作负极活性材料,电解质溶液为浓KOH,溶液两边用羧甲基纤维素作隔膜。锌银电池的负极是Zn,正极是Ag2O,电解质是KOH,其总的反应式为:
Zn+Ag2O=2Ag+ZnO。
(1)写出正、负极的电极反应式:负极:。
正极:。
(2)电池工作过程中,电池负极溶液的PH(填“增大”、“减小”或“不变”)
用相应的离子方程式说明原因:
(1)配制氯化铁溶液时,往往需要加入少量的稀盐酸:。
(2)热的纯碱溶液可以用来除油污:。
(3)泡沫灭火器中装的是NaHCO3和Al2(SO4)3两种浓溶液,可用来灭火:。
已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s)  mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=[c(Mn+)]m×[c(Am-)]n 称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
| 难溶电解质 |
CaCO3 |
CaSO4 |
MgCO3 |
Mg(OH)2 |
| Ksp |
2.8×10-9 |
9.1×10-6 |
6.8×10-6 |
1.8×10-12 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④_____________________________________________________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:______________________________________。
(3)设计第③步的目的是___________________________________________________。
(4)请补充第④步操作及发生的现象:_____。