(13分)
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) 2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
2NH3(g) △H=" -92.4" kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),判断的依据是: 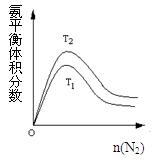
(3)合成氨气所需的氢气可以由水煤气分离得到。涉及反应信息如下:
反应一:C(s)+H2O(g) H
H 2(g)+CO(g) 平衡常数K1
2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1=
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
1 |
2 |
0.8 |
1.2 |
5 |
| 2 |
900 |
0.5 |
1 |
0.2 |
0.8 |
3 |
| 3 |
T |
a |
b |
c |
d |
t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填序号)
| A.其它条件不变温度T<900℃ | B.其它条件不变温度T>900℃ |
| C.充入一定量氖气 | D.使用高效催化剂 |
(Ⅲ)对于反应二,当升高温度时K2 (填“增大”、“减小”或“不变”)。
(共4分)实验室可以用饱和FeCl3溶液制备Fe(OH)3胶体。
(1)写出制备Fe(OH)3胶体的化学方程式
(2)取烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加稀盐酸至过量,边滴边振荡,可以看到的现象是。
某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜(含有少量的锌、铁、银、金等金属和少量矿物杂质)的提纯,并对阳极泥和电解液中金属进行回收和含量测定。请回答以下问题。
(1)电解时,粗铜应与电源的极相连,阴极上的电极反应式为;电解过程中,硫酸铜的浓度会(选填“变大”“不变”或“变小”)。
(2)电解完成后,该小组同学将电解液过滤后对滤液和阳极泥分别进行处理:
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:。
②Cu的回收、滤液成分及含量的测定:以下是该小组设计的一个实验流程。
在上述流程中空格内填上相应的操作:、;100 mL滤液中Cu2+的浓度为 mol/l,Fe2+的浓度为mol/l。
I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为,其电极均由石墨材料做成,则电解时不断消耗的电极是(填“阴极”或“阳极”),冰晶石的作用为。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为,正极附近溶液的pH(填“变大”“不变”或“变小”)。
已知:①2Al(s)+3Cl2(g)=2AlCl3(s)△H1=-1390 .8kJ/mol
②4Al(s)+3O2(g)=2Al2O3(s)△H2=-3339.6kJ/mol
③2C(s)+O2(g)=2CO(g)△H3=-221.0kJ/mol
Al2O3(s)+ 3C(s)+3Cl2(g)=2AlCl3(s)+3CO(g)的△H=。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,请写出合成氨的热化学反应方程式:(ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为 在一定温度下,
在一定温度下,
将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是。
| A.增大压强 | B.增大反应物的浓度 | C.使用催化剂 | D.降低温度 |
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2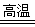 6SO2+Fe3O4,有3 m01FeS2参加反应,转移mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式:。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示,铅蓄电池的总反应方程式为,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为,MnO2的理论产量为g。
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下图(图中部分产物未列出):
请填写下列空白:
(1)A是,G是。(用化学式填写)
(2)H与盐酸反应生成E的化学方程式是。
(3)E与F反应的化学方程式是。
(4)F与G的水溶液的反应生成I和D的离子方程式是。
(5)向H溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,但该反应中没有放出E气体,则该反应的离子方程式。
(6)将2.5 g H、I和碳酸氢钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:则物质I的物质的量为_______________mol。
某小组同学欲探究NH3催化氧化反应,按下图装置进行实验。
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH固体、MnO2 
(1)NH3催化氧化的化学方程式是。
(2)装置B中产生气体的原因有(结合化学用语解释)。
(3)甲乙两同学分别按上述装置进行实验。一段时间后,装置G中溶液都变成蓝色。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是。
②乙观察到装置F中只有白烟生成,白烟的成分是(写化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:。
(4)为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进。甲认为可调节K1和K2控制A、B装置中的产气量,应(填“增加”或“减少”)装置A中的产气量,或(填“增加”或“减少”)装置B中的产气量。
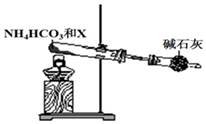
(5)为实现该反应,也可用下图所示的装置替换上述装置中虚线框部分,化合物X为。NH4HCO3的作用是。