A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下图(图中部分产物未列出):
请填写下列空白:
(1)A是 ,G是 。(用化学式填写)
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液的反应生成I和D的离子方程式是 。
(5)向H溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,但该反应中没有放出E气体,则该反应的离子方程式 。
(6)将2.5 g H、I和碳酸氢钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:则物质I的物质的量为_______________mol。
已知由短周期元素组成的A、B、C、D四种常见化合物分子中所含原子数目依次为2、3、4、5,其中A、B含有18个电子,C、D含有10个电子。请回答:
(1)D中含有的化学键类型有,已知8gD与O2完全燃烧,生成稳定化合物时放出445kJ的热量,写出反应的热化学方程式。
(2)室温下,若向一定量C的稀溶液中逐滴加入物质的量浓度相同的A,直至A过量,生成化合物XY4Z(X 、Y、Z表示元素符号)。讨论上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白(要求填写有关粒子化学式):
、Y、Z表示元素符号)。讨论上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白(要求填写有关粒子化学式):
| 离子浓度由大到小的顺序 |
溶质的化学式 |
溶液的pH |
|
| I |
c(XY+4)>c(Z—)>c(OH—)>c(H+) |
pH>7 |
|
| II |
c(XY+4)=c(Z—) |
XY4Z、XY3·H2O |
|
| III |
XY4Z |
pH<7 |
|
| IV |
c(Z—)>c(H+)>c(XY+4)> >c(OH—) |
pH<7 |
(3)B在空气中完全燃烧生成E,在一定条件下发生E与O2反应生成F。
①将0.05molE和0.03molO2放入容积为1L的密闭容器中,达到平衡,测得c(F)=0.04mol·L—1。计算该条件下反应的平衡常数K=和E的平衡转化率。
②已知上述反应是放热反应,当该反应处于平衡状态时,下列措施中有利于提高E平衡转化率的有(填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
将等物质的量的A、B、C、D四种物质混和,发生如下反应: aA+bB cC(固)+dD当反应进行一定时间后,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol,此时达到化学平衡:
cC(固)+dD当反应进行一定时间后,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol,此时达到化学平衡:
(1)该化学方程式中各物质的系数为a=_______,b=______,c_______,d=_____。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态A_______,B________,D_________。
(3)该反应的平衡常数表达式为K=。若升高温度,达到平衡后平衡常数减小,则该反应为________反应(填放热或吸热)
在一个密闭容器中,保持一定的温度和压强进行以下反应:
A(g) +3B(g )
)  3C(g),已知加入1 molA和3 molB,平衡时A的物质的量为a mol。
3C(g),已知加入1 molA和3 molB,平衡时A的物质的量为a mol。
(1)达到平衡时C在反应混合体中体积百分含量是(用含 a的关系式表示)
a的关系式表示)
(2)在相同的实验条件下,若在 同一个容器中改为加入2 molA和6 molB,达到平衡后, C在混合气体中的体积百分含量(填“增大”“减小”或“不变”)。
同一个容器中改为加入2 molA和6 molB,达到平衡后, C在混合气体中的体积百分含量(填“增大”“减小”或“不变”)。
(3)在相同的实验条件下,如果加入n mol A、m mol B和p molC,若要求平衡后C在混合气体中的百分含量保持不变,与(1)相同,则n、m与p的关系式为。
(10分) (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
①丙烷脱氢可得丙烯。已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6 kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2 (g)+H2(g)的△H=kJ·mol-1。
②以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应总方程式为
;放电时CO32-移向电池的(填“正”或“负”)极。
(2) 反应A(g)+B(g)
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。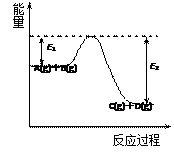
①该反应是_______________反应(填“吸热”“放热” );
②在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小”“不变” );
③反应体系中加入催化剂对反应热是否有影响?_____________,原因是______________________________________________________________________。
(12分)(1)已知离子反应: +6I—+6H+=R—+3I2+3H2O,n=,R元素在
+6I—+6H+=R—+3I2+3H2O,n=,R元素在 中的化合价是。
中的化合价是。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: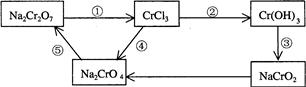
①在上述有编号的步骤中,需用氧化剂的是(填编号)。
②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
__Na2Cr2O7+__KI+__HCl——__CrCl3+_NaCl+__KCl+__I2+ (用单线桥表示电子转移的方向、数目)
(用单线桥表示电子转移的方向、数目)
当反应中有3mol电子转移时,氧化产物的质量是。