过渡金属催化的新型碳-碳偶联反应是近年来有机合成的研究热点之一,如:
反应①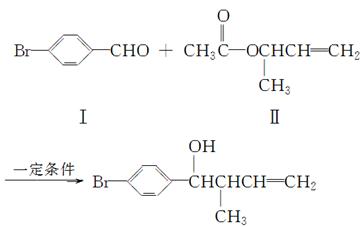
化合物Ⅱ可由化合物Ⅲ合成:
C4H7Br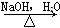 CH3CHCHOHCH2
CH3CHCHOHCH2
Ⅲ Ⅳ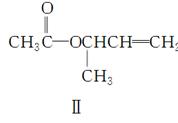
(1)化合物Ⅰ的分子式为________。
(2)化合物Ⅱ与Br2加成的产物的结构简式为________。
(3)化合物Ⅲ的结构简式为________。
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式为____________________________(注明反应条件)。因此,在碱性条件下,由Ⅳ与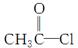 反应合成Ⅱ,其反应类型为________。
反应合成Ⅱ,其反应类型为________。
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应。Ⅴ与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为________(写出其中一种)。
(11分) A、B、C、D、E、F、G、H和I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;
②A和I相遇产生白色的烟;
③B和E都能使品红溶液褪色;
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;
⑤将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥C和D相遇生成红棕色气体;
⑦G在D中燃烧可以产生E和H2O;
⑧将B和H在瓶中混合后于亮处放置几分钟,瓶内壁出现油状液滴并产生A。
回答下列问题:
(1)A的化学式是________,②中烟的化学式是________;
(2)④中发生反应的化学方程式是
________________________________________________________________________;
(3)⑤中发生反应的化学方程式是
________________________________________________________________________;
(4)C的化学式是__________,D的化学式是__________;
(5)⑦中发生反应的化学方程式是
________________________________________________________________________;
(6)H的化学式是________。
(14分)阅读讨论并完成以下各项内容:
SO2是常见的大气污染物之一,我国规定空气中SO2含量不得超过0.02 mg/L。
(1)酸雨是降水呈酸性(pH小于5.6)的统称,个别地方甚至低于2.1(食醋的pH=3)。引起酸雨的罪魁祸首是大气中的SO2和氮的氧化物。它们的主要来源是煤和石油的燃烧,全世界每年排放1.5亿吨的SO2。
①SO2可在空气中受光照等因素作用而被氧化,最终与雨水形成硫酸型酸雨。试写出这两个化学反应的方程式
________________________________________________________________________;
________________________________________________________________________。
②汽车排放的尾气、硝酸厂和化肥厂的废气中都含有氮的氧化物,全世界每年排放量约为5×107 kg。NO2溶于水生成 ________和NO。
③酸雨可导致的危害有________(填序号)。
A.腐蚀建筑物 B.导致树木枯萎
C.造成洪涝灾害 D.恶化人类环境
④为了减少酸雨的形成,必须减少SO2的排放量,对燃料中的硫化物进行________,对废气中的氮的氧化物用________吸收。
(2)某化学兴趣小组选用下图实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量(已知碘能氧化H2SO3,生成H2SO4)。
①若原料气从左向右流时,上述装置连接的顺序是:原料气→________(用字母和箭头表示)。
②装置②中发生反应的离子方程式为:
________________________________________________________________________;
当装置②中出现________现象时,立即停止通气。
③你认为下列试剂中,可以用来代替试管中的碘的淀粉溶液的是________。
A.酸性KMnO4溶液 B.NaOH溶液
C.溴水 D.氨水
直接排放含SO2,的烟气会形成胶雨,危害环境。利用钠碱循环法可脱除烟气中的SO2
(1)在钠碱循环法中,Na2 SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,
该反应的离子方程式是
(2)吸收液吸收SO2的过程中,pH随n(SO3²-):n(HSO3﹣变化关系如下表:
| n(SO3²--):n(HSO3﹣) |
91:9 |
1:1 |
9:91 |
| PH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性,原因:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a、C(Na+)==2C(SO32-)+C(HSO3-)
b、C(Na+)> C(HSO3-)> C(SO32-)>C(H+)==C(OH-)
c、C(Na+)+ C(H+)="=" C(SO32-)+ C(HSO3-)+ C(OH-)
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按下图所示步骤进行操作。回答下列问题:
(1)起始滤液的pH7(填“大于”、“小于”或“等于”),其原因是(用方程式表达)
(2)试剂I的化学式为,
(3)③中发生反应的化学方程式为;
5000C下发生如下反应H2(g)+CO2(g) H2O(g)+CO(g)△H<0,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。(已知此温度下该反应的平衡常数K=
H2O(g)+CO(g)△H<0,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示。(已知此温度下该反应的平衡常数K= )
)
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
(1)、平衡时,甲中CO2转化率为
在甲、乙、丙三个恒容密闭容器中CO2转化率大小比较
(2).丙中达平衡需要20S,则反应速率V(CO2)=
(3).甲中的反应速率-时间图像如图,在图中画出丙的反应速率-时间图像
(4)升高温度,平衡常数K (填 “大于”“小于”“等于”)
(填 “大于”“小于”“等于”)