能够水解的某有机化合物A经里比希法测得其中含碳为72.0%、含氢为 6.67%,其余含有氧。
现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。如下图A。
方法三:利用红外光谱仪测得A分子的红外光谱如下图B。
试填空。
(1)A的分子式为_______________________。
(2)A的分子中只含一个甲基的依据是_______________(填序号)。
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(3)A的结构简式为 ___________________________ 。
如图是广州亚运会开幕式“红棉花开迎宾来”焰火盛宴的一个场景,
请回答下列问题:
(1)焰火利用了部分金属的元素特征的反应,该反应属于(填“物理”或“化学”)变化。
(2)现在有一种火焰的引发是当浓H2SO4滴下去跟氯酸钾起作用时,便生成了奇臭的二氧化氯气体,且发现只有氯元素的化合价发生变化。请写出该反应的方程式。
(3)如图所示的五元环代表A、B、C、D、E五种化合物,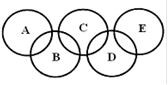
圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为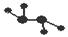 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
①D的化学式是_________.
②A、B、E中均含有的一种元素名称为______________。
③B的电子式是______________。
④C与纯碱反应的化学方程式为。
(8分)已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸 K=1.75×10-5次氯酸 K=2.95×10-8
碳酸K1=4.30×10-7 K2=5.61×10-11亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式K1=__________。
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是________。等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为。
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________。
a.c(CH3COO-)b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO3—+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-=== HCO3—
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: 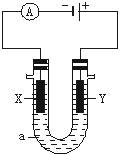
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为_______________。在X极附近观察到的现象是________________。
②Y电极上的电极反应式为_________________,检验该电极反应产物的方法是___________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是__________,电极反应式为________________。
②Y电极的材料是__________,电极反应式为_______________。(说明:杂质发生的电极反应不必写出)
(10分)
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应正极电极反应式为_______;放电时,CO32-移向电池的______(填“正”或“负”)极。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
(1)通过NOx传感器可监测NOx的含量,固体体电解质可以传导O2-其工作原理示意图如下: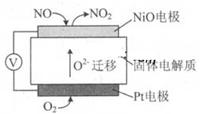
①Pt电极上发生的是反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:。
(2)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。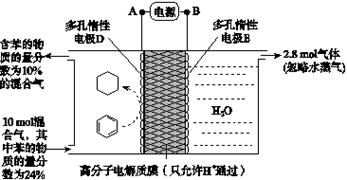
①导线中电子移动方向为________。(用A、D表示)
②生成目标产物的电极反应式为__________________。
③该储氢装置的电流效率η=____________________。(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)