在25 ℃时,用石墨电极电解2.0 L 2.5 mol·L-1CuSO4溶液,如有0.20 mol电子发生转移,请回答下列问题:
(1)阴极发生反应,
电极反应式为;
(2)阳极发生反应,
电极反应式为;
(3)电解后得到的铜的质量是,得到氧气的体积是(标准状况),溶液的pH是;
(4)如果用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差,电解液的pH。
某实验小组的同学采用如图所示装置来进行有关化学实验,请填充下列空格。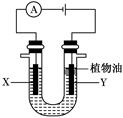
(1)若U形管中盛有硫酸钠溶液,X、Y电极分别为石墨和铁棒,电解过程中出现的现象是。
U形管中加入的少量植物油作用是。
(2)电解一段时间后,某同学将电源反接,此时出现的现象是。有关的化学方程式为。
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-―→2O2-)。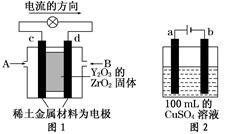
(1)c电极的名称为,d电极上的电极反应式为。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为,若a电极产生56 mL(标准状况)气体,则所得溶液的pH=(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入(填序号)。
a.CuOb.Cu(OH)2
c.CuCO3d.Cu2(OH)2CO3
在一个U形管里盛有CuCl2溶液,并插入两块锌片作电极,按如图连接。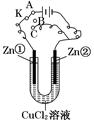
(1)如果把电键K接A,该装置应是电解装置,Zn①极是极,电极反应式为,Zn②极是极,电极反应式为。
(2)上述反应进行5 min后,转换电键K到C,则这个装置是原电池装置,Zn①极是极,电极反应式为。
(3)上述装置进行2 min后,再转换电键K到B,则Zn①极发生的化学反应为,Zn②极发生的有关电化学的反应为。
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 |
HA的物质的量浓度(mol·L-1) |
NaOH的物质的量浓度(mol·L-1) |
混合后溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸?
。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是。
A.前者大B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=mol/L。
(Ⅱ)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)