分类作为一种重要的科学思想,在科学研究中占有重要地位。氧化还原反应有多种分类方法,其中根据参与电子转移的元素种类不同的分类方法最常见。下列所供反应中电子转移发生在相同价态的同种元素之间的有___________(填反应编号,下同);电子转移发生在不同价态的同种元素之间的有___________;电子转移发生在不同元素之间的有___________。
①C+CO2 2CO
2CO
②NH4NO3 N2O↑+2H2O
N2O↑+2H2O
③2KClO3 2KCl+3O2↑
2KCl+3O2↑
④S+2KNO3+3C K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
⑤3Cl2+6NaOH 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
⑥HgS+O2 Hg+SO2
Hg+SO2
某强氧化剂 被亚硫酸钠还原到较低价态,如果还原24个
被亚硫酸钠还原到较低价态,如果还原24个 到较低价态,需要用含60个
到较低价态,需要用含60个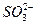 的溶液,那么X元素的最终价态为___________。
的溶液,那么X元素的最终价态为___________。
在下列两个反应中被氧化的氯元素与被还原的氯元素的质量之比各为多少?
(1)2Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O
(2)3Cl2+6KOH 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
在S2-、Fe2+、Mg2+、S、I-、H+、Fe3+中,只有氧化性的是_________;只有还原性的是_________;既有氧化性又有还原性的是_________。
(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
___________+___________ ___________+___________+___________+H2O
___________+___________+___________+H2O
(2)反应物中发生氧化反应的物质是___________,被还原的元素是___________。
(3)反应中1 mol氧化剂___________(填“得到”或“失去”) ___________mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中: ___________+
___________+ ___________
___________