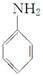
商品名称为“敌稗”的有机物F是一种优良的水稻除草剂,现通过下列合成路线制备: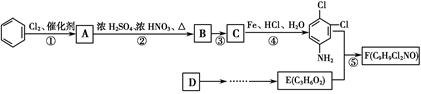
已知:Ⅰ. 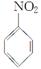
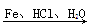
 (呈碱性)
(呈碱性)
Ⅱ.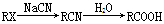
Ⅲ.苯环上原有取代基对苯环上新引入的取代基的位置有一定影响,使新的取代基进入它的邻位、对位的取代基有:—CH3、—NH2、—X(卤素原子);使新的取代基进入它的间位的取代基有:—COOH、—NO2等。
请回答:
(1)F的结构简式为________。
(2)反应②的化学方程式为______________。
(3)有人认为若将②、③两步反应顺序颠倒,也可以得到C,实际上是不妥的。请你指出不妥之处_______________________________________________。
(4)绿色化学追求充分利用原料中原子,实现零排放或少排放。就该流程而言,为了实现这一点,我们该做的是_________________________________________________________。
(5)若原料D为乙烯,根据提供的信息,设计D→E(C3H6O2)的合成路线。
合成反应流程图表示方法: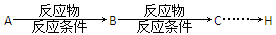
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的 H2还原 CuO粉末来测定 Cu的相对原子质量,同时检验氯气的氧化性。
(1)写出甲中发生反应的离子方程式
(2)为完成上述实验,正确的连接顺序为A连;B连 (填写连接的字母)。
(3)对硬质玻璃管里的氧化铜粉末加热前,需要的操作为。
(4)若检验氯气的氧化性,则乙装置的 a瓶中溶液可以是,对应的现象为 。
(5)丙装置的 c瓶中盛放的试剂为,作用是。
(6)测定 Cu的相对原子质量:精确测量硬质玻璃管的质量为Ag,放入CuO后,精确测量硬质玻璃管和 CuO的总质量为Bg,实验完毕后精确测量硬质玻璃管和 Cu粉的总质量为cg。Cu的相对原子质量表达式(用 a、b、c表示)为。(已知氧的相对原子质量为 16)
硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
已知几种盐的溶解度随温度变化的
曲线如右图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧 FeCO3生成产品 I的化学反应方程式为 _______。
实验室进行煅烧操作所需仪
器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为 _______________,为了获得产品Ⅱ,向 (NH4) 2SO4溶液中加入KCl溶液后,还需要进行的操作是:。
2SO4溶液中加入KCl溶液后,还需要进行的操作是:。
(4)检验产品 II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,。
373K时,某 1L密闭容器中加入1molPCl5发生如下可逆反应: 其中物质PCl3的物质的量变化如右图所示。
其中物质PCl3的物质的量变化如右图所示。
(1 )前 20
)前 20 s内 PCl5(g)的平均反应速率为
s内 PCl5(g)的平均反应速率为
(2)373K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入 1mol的 PCl5,与原平衡比较,新平衡时 PCl5的转化率(填“增大”或“减小”,下同)。PCl5的平衡浓度。
(4)将原平衡升温至 473K,重新达平衡时(其他条件不变),PCl3的平衡浓度为 PCl5的3倍,该反应的正反应为(填“放热反应”或 “吸热反应”),为增大平衡体系中 Cl2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积
c.加入合适的催化剂 d.再充入 PCl3
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀生成,向所得滤液(滤出0.58g沉淀),逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示[图中的Y表示沉淀质量(g), x表示加入盐酸体积(mL)]
(1) 混合物中NaOH质量是____________g(2`),
MgCl2和AlCl3的物质的量之比是________(2`)
(2) P点所表示的加入盐酸的体积为________ml.(2`)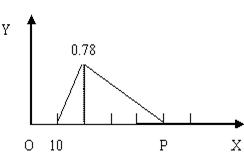
某无色溶液里,只含有下列8种离子中的某几种:
Mg2+、H+、Ag+、Na+、Cl—、HCO3—、OH—、NO3—。
已知该溶液能跟金属铝反应,且放出的气体只有氢气。试回答:
(1)若溶液跟铝反应后只有AlO2—生成,则原溶液一定含有的大量物质是(写化学式)_______________,发生反应的化学方程式是_____,还可能含有的大量物质是_________。.
(2)若溶液跟铝反应后有Al3+生成,则原溶液一定不含有的大量离子是__________