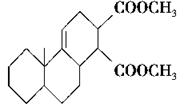
共轭双烯与含有双键的化合物相互作用,能生成六元环状化合物,常用于有机合成,例如: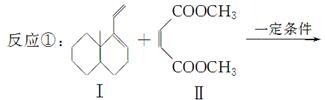
化合物Ⅱ可发生以下反应:
Ⅱ Ⅲ(分子式为C4H4O4)
Ⅲ(分子式为C4H4O4)  Ⅳ(高分子化合物)
Ⅳ(高分子化合物)
(1)化合物I的分子式为________,1 mol该物质完全燃烧需消耗________mol O2。
(2)反应②的化学方程式为__________________________________________。
(3)反应③是缩聚反应,化合物Ⅳ的结构简式为________。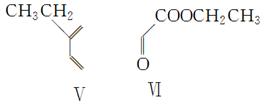
(4)在一定条件下,化合物Ⅴ和化合物Ⅵ能发生类似反应①的反应,生成两种化合物(互为同分异构体),这两种化合物的结构简式分别为________、________。
(5)下列关于化合物Ⅰ、Ⅱ、Ⅴ、Ⅵ的说法正确的有________(填字母)。
| A.Ⅰ属于芳香烃 |
| B.Ⅰ、Ⅱ、Ⅴ均能使溴的四氯化碳溶液褪色 |
| C.Ⅴ与足量H2加成后的产物是3-甲基戊烷 |
| D.加热条件下Ⅵ能与新制Cu(OH)2反应生成红色沉淀 |
在①油脂②纤维素③蛋白质三种物质中,可用于制肥皂的是(填序号,下同),遇浓硝酸显黄色的是,可用于造纸的是。
下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
| ① |
|||||||||||||||||
| ④ |
⑤ |
⑥ |
|||||||||||||||
| ② |
⑦ |
||||||||||||||||
| Fe |
As |
||||||||||||||||
I.元素周期表是人们研究物质性质的重要工具
Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为,当消耗1mol还原剂时,电子转移了 ________mol。
Ⅱ.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)
(1)若E为氧化物,则A的化学式为,A与水反应的化学方程式为,该反应中氧化剂和还原剂的物质的量之比为。
①当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为,表示X呈碱性的离子方程式为。
②当X为金属单质时,则X与B的稀溶液反应生成C的离子反应方程式为
(2)若E为单质气体,D为白色沉淀,A的化学式可能是,B含有的化学键类为,C与X反应的离子方程式为。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,则该可逆反应的化学方程式为。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达平衡,该温度下反应的平衡常数K=1,D的转化率为。
短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物,它们之间有图示的转化关系,已知C为密度最小的气体,甲俗称刚玉,是红宝石的主要成分。
⑴写出丙的名称:。
(2)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式。
②甲与NaOH溶液反应的离子方程式。
③乙溶液与过量CO2反应的离子方程式。
(3)甲的用途是(任写一种);A与Fe2O3的反应类型为。
短周期元素X、Y、Z、W原子序数依次增大。X是形成化合物种类最多的元素,Y是自然界含量最多的元素,Z是同周期中金属性最强的元素,W的负一价离子与Y的某种氢化物分子含有相同的电子数。
(1)元素X、Y、Z按原子半径由大到小的顺序排列为。(用元素符号表示)。
(2)W的单质与水反应的离子方程式为。
(3)化合物A由X、Y、Z三元素共同构成,其浓溶液中通入W的单质时,可产生气体XY2和化合物ZWY3。反应的化学方程式为。
A、B、C、D、E是Na的单质及其化合物,它们有如图所示的相互转化关系。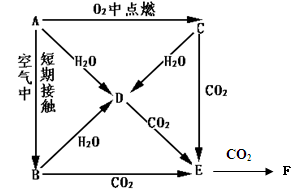
(1) 写出以下物质的化学式:CF
(2) 完成以下离子方程式:
C→D:
D→E:
(3) 等质量的A和B分别投入到等质量且足量的水中,反应后所得溶液溶质质量分数分别为
ω1、ω2,则ω1ω2 (填“>”或“<”或“==”)。
(4) E中混有少量的F,用化学方程式表示除去F的两种方法:
、
(5) 用m g的D来制取纯净的E,写出最简单的实验方法