下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:
KHCO3 ,溶液呈 性;
K2SO4 ,溶液呈 性;
CuCl2 ,溶液呈 性。
根据要求回答下列问题:
(1)硝酸钠、75%的酒精溶液、Fe(OH)3胶体、豆浆这些物质能与Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)归为一类的是 。
(2)下列仪器:容量瓶、蒸馏烧瓶、漏斗、分液漏斗,其中不能用于物质分离的是 。
(3)四大基本反应中,一定没有发生电子转移的是 。
(4)下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A 分液 B 过滤 C 萃取 D 蒸馏 E 蒸发结晶 F 高温分解
①分离CCl4和H2O: ;
②除去澄清石灰水中悬浮的CaCO3: ;
③除去CaO固体中少量的CaCO3固体: ;
④从碘水中提取碘: ;
⑤分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物: 。
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)ΔH = -49.0kJ·mol-1,
2CH3OH(g) =CH3OCH3(g)+ H2O(g)ΔH =-23.5kJ·mol-1,
则CO2与H2反应合成二甲醚的热化学方程式为 。
(2)若反应2CH3OH(g)  CH3OCH3(g)+ H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
CH3OCH3(g)+ H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
| 物质 |
CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
| 浓度(mol·L-1) |
0.44 |
0.60 |
0.60 |
①写出该反应的平衡常数表达式:K= 。
②比较该时刻正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”)
③若加入甲醇后经 10 min 反应达到平衡,则平衡后c(CH3OH)= ,该时间内反应速率v(CH3OCH3)= 。
(3)工业上合成甲醇的反应:CO(g)+2H2(g) CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molCO、2 mol H2 |
1 mol CH3OH |
2 mol CO、4 mol H2 |
| CH3OH的浓度(mol/L) |
c1=0.25 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
| 平衡常数 |
K1 |
K2 |
K3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
①下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是 。
A. v正(H2)= 2v逆(CH3OH) B. n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2 : 1
C. 混合气体的密度不变 D. 混合气体的平均相对分子质量不变
E. 容器的压强不变
②下列说法正确的是 。
A. c1= c2 B. Q1= Q2 C. K1= K2 D. α2+α3 < 100%
③如图表示该反应的反应速率v和时间t的关系图:
各阶段的平衡常数如下表所示:
| t2~t3 |
t4~t5 |
t5~t6 |
t7~t8 |
| K4 |
K5 |
K6 |
K7 |
K4、K5、K6、K7之间的关系为 (填“>”、“<”或“=”)。反应物的转化率最大的一段时间是 。
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,请回答:
(1)“O”点导电能力为“0”的理由是 ;
(2) a、b、c三点的c(H+)由小到大的顺序为 ;
(3) a、b、c三点处,电离程度最大的是 ;
(4) 若使c点溶液中c (CH3COO-)增大,c (H+)减小,则可采取的措施是(填写物质化学式):① , ② ;
(5) 稀醋酸稀释过程中,始终保持增大趋势的是 。
A c (H+) B n (H+) C c(OH-) D n (CH3COOH ) E c(H+) / c(CH3COOH)
T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为 ,正反应为________(填“吸热”或“放热”)反应。
(2)在密闭容器中,加入2 mol A和6 mol B。
① 当反应达到平衡时,A和B的浓度比是_______;A和B的转化率之比是_______。
② 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③ 当达到平衡时,充入氩气,并保持压强不变,平衡将______(填“正向”、“逆向”或“不”)移动。
④ 若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“正向”、“ 逆向”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
(1)下列物质中能导电的是 ,属于电解质的是 ,属于非电解质的是 。
①H2SO4,②蔗糖,③熔融硫酸钠,④NH3·H2O ,⑤CO2,⑥碳酸钙,⑦CH3COOH, ⑧铜,⑨氯气,⑩石墨
(2)下列变化过程,属于放热反应的是 。
①弱酸电离, ② 酸碱中和反应, ③NH4Cl晶体与Ba(OH)2·8H2O混合搅拌, ④ 固体NaOH溶于水 ,⑤ H2在Cl2中燃烧 ,⑥液态水变成水蒸气 ,⑦ 浓H2SO4稀释, ⑧ 碳和二氧化碳反应生成一氧化碳
(3)已知:4HCl(g) + O2(g) = 2Cl2(g) + 2H2O(g)ΔH = -115.6kJ·mol-1
H2 (g) + Cl 2(g) = 2HCl(g)ΔH = -184kJ·mol-1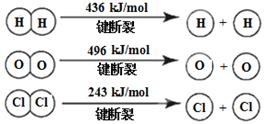
① H2与O2反应生成气态水的热化学方程式是 , ②断开 1 mol H-O键所需能量为 kJ。