有下列物质:①Fe ②CO2 ③H2SO4 ④Ba(OH)2溶液 ⑤氨水 ⑥NaHSO4
其中属于酸的是 (填序号,下同),属于盐的是 ,属于氧化物的是 ,属于电解质的是 ,可导电的是 。
用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g)△H=-196.46kJ·mol-1
H2(g)+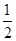 O2(g)=H2O(l)△H=-285.84kJ·mol-1
O2(g)=H2O(l)△H=-285.84kJ·mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热方程式为
已知Fe3+与I-在水溶液中发生:2I-+2Fe3+=2Fe2++I2。该反应正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)·cn(Fe3+)(其中k为常数)。
| cm(I-)(mol/L)m |
cn(Fe3+)[(mol/L)n] |
v[mol/(L·s)] |
|
| a |
0.20 |
0.80 |
0.032 |
| b |
0.60 |
0.40 |
0.144 |
| c |
0.80 |
0.20 |
0.128 |
I-浓度对反应速率的影响________Fe3+浓度对反应速率的影响(填大于或小于或等于)
已知下列反应的平衡常数:
(1)HCN H+ + CN-,K(1)Θ =" 4.9" ×10-10
H+ + CN-,K(1)Θ =" 4.9" ×10-10
(2)NH3 + H2O  NH4+ + OH-,K(2)Θ =" 1.8" ×10-5
NH4+ + OH-,K(2)Θ =" 1.8" ×10-5
(3)H2O H+ + OH-,KwΘ =" 1.0" ×10-14算出NH3 + HCN
H+ + OH-,KwΘ =" 1.0" ×10-14算出NH3 + HCN  NH4+ + CN-,反应平衡常数的K值是_________________
NH4+ + CN-,反应平衡常数的K值是_________________
依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________________________
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为____________________。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________________
(8分)已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g)  C(g)△H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g)△H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”)。
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______。
| A.一定向正反应方向移动 | B.一定向逆反应方向移动 |
| C.一定不移动 | D.不一定移动 |
(3)若使温度、压强在上述条件下恒定不变,在密闭容器中充入2mol A和2 mol B,则反应达到平衡时,C的体积分数为_______;容器的容积为_______。