依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为____________________________________
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为____________________。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________________
碘在人体生命活动中具有重要作用,人从食物中摄取碘后,碘便在甲状腺中积存下来,通过一系列的化学反应形成甲状腺素,甲状腺素的结构为:
(1)甲状腺素的分子式为_____________________。
(2)在甲状腺内,甲状腺素的合成过程可能是
试写出上述两步反应的化学方程式,并注明反应类型
①________________________________________②
乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业。乙酸苯甲酯可以用下面的设计方案合成。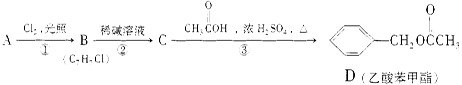
(1)写出A的结构简式:
A,C:
(2)D有很多同分异构体,含有酯基和一取代苯结构的同分异构体有五个,其中三个的结构简式是
请写出另外两个同分异构体的结构简式:
和
酸牛奶中含有乳酸,其结构为
(1)乳酸可能发生的反应是(填序号)
①取代反应②酯化反应③水解反应④消去反应⑤加聚反应⑥中和反应
(2)乳酸自身在不同条件下可形成不同的酯,其中式量最小的酯的结构简式是反应原理,形成高分子化合物的酯的结构简式。
有四种有机物A、B、C、D,其分子式均为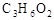 ,把它们分别进行实验并记录现象如下:
,把它们分别进行实验并记录现象如下: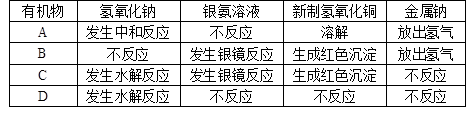
四种物质的结构式为:
A.; B.;
C.; D.。
天然橡胶的结构简式为 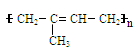 。盛放溴水的试剂瓶不能用
。盛放溴水的试剂瓶不能用
天然胶制的橡皮塞,其原因是