已知下列反应的平衡常数:
(1)HCN H+ + CN-, K(1)Θ =" 4.9" ×10-10
H+ + CN-, K(1)Θ =" 4.9" ×10-10
(2)NH3 + H2O  NH4+ + OH-, K(2)Θ =" 1.8" ×10-5
NH4+ + OH-, K(2)Θ =" 1.8" ×10-5
(3)H2O H+ + OH-, KwΘ =" 1.0" ×10-14算出NH3 + HCN
H+ + OH-, KwΘ =" 1.0" ×10-14算出NH3 + HCN  NH4+ + CN-, 反应平衡常数的K值是_________________
NH4+ + CN-, 反应平衡常数的K值是_________________
纯水在20 ℃的pH(填“大于”或“小于”)80 ℃时的pH。
可逆反应: 根据图回答:
根据图回答: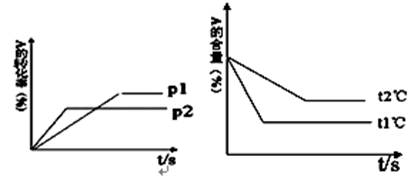
(1)压强 P1比P2(填“大”或“小”);
(2)(a +b)比(c +d)(填“大”或“小”);
(3)温度t1℃比t2℃(填“高”或“低”);
(4)正反应为反应(填“吸热”或“放热”);
DAP-A树脂(下列路线图中的β、γ聚合物)是一种优良的热固性树脂,被用作高级UV油墨的一种成分。用UV油墨印刷的优点是:印刷时油墨极快干燥,对环境及人员无损害,性价比较高。因此,适于大规模生产食品、酒类、洗涤剂等包装纸盒。以下是以石油化工产品为原料,合成该材料的路线: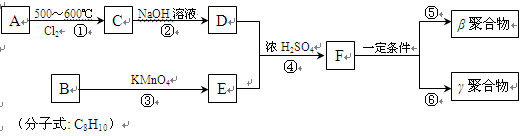
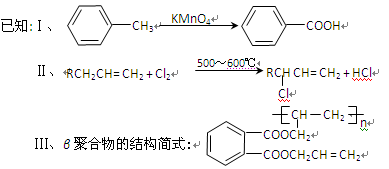
试回答下列问题:
(1)A的名称是 。
(2)在①~④的反应中属于取代反应的是 。
(3)B的结构简式是 ,B苯环上的二氯代物有 种。
(4)写出反应④的化学方程式:
。
(5)工业上可由C经过两步反应制得甘油(丙三醇),写出第二步反应的化学方程式
。
(6)γ聚合物和β聚合物相比,下列说法合理的是 。
| A.它们互为同分异构体 | B.它们含碳的质量分数相同 |
| C.γ聚合物中可能几乎不含碳碳双键 | D.不能发生水解反应 |
透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种方法中含有下列四种物质:
请填写下列空白:
(1)甲中不含氧原子的官能团是;
下列试剂能与甲反应而褪色的是(填标号)
| A.Br2/CCl4溶液 | B.石蕊溶液 | C.酸性KMnO4溶液 | D.甲基橙 |
(2)甲的同分异构体有多种,写出其中一种不含甲基、不能使溴水褪色且显酸性的结构简式:。
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):
A的化学式是,C→D的反应类型是。
(4)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显紫色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为。
某混合金属粉末,除Mg外,还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中铝、锌元素的存在。所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O。
背景资料:
①锌与铝性质相似,可以与NaOH溶液反应生成H2和Na2ZnO2;
②Zn(OH)2为白色固体,难溶于水,可溶于强碱和氨水。与氨水反应生成配合物[Zn(NH3)4]2+,该配合物遇强酸反应生成Zn2+、NH4+
甲同学设计的实验方案如下: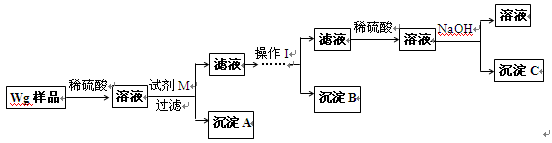
(1)方案中试剂M是;沉淀B是。
(2)操作Ⅰ的主要过程是:在滤液中逐滴加入,直至生成的沉淀刚好溶解,再加入足量的。
(3)若金属中含铝,则沉淀(选填沉淀编号)的质量不为零;若金属中含锌,则沉淀(选填沉淀编号)的质量不为零。
(4)乙同学对甲同学的方案做了如下改进:
与甲同学的方案相比,此方案的优点有。
(5)某溶液中含有Zn2+、Al3+、NH4+和SO42-等离子,向其中逐滴加入NaOH溶液,则生成沉淀的物质的量与加入NaOH溶液体积关系的图像正确的是。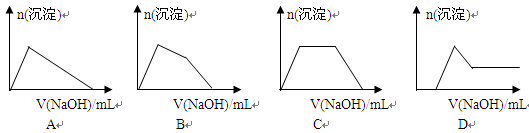
(6)上题中当沉淀质量最大时,溶液呈(从下列选项中选填,下同);当沉淀只有一种成分时,溶液可能呈。
| A.酸性 | B.中性 | C.碱性 | D.可能酸性,也可能碱性 |