“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间 |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v (CO2)表示的反应速率为 (取小数二位,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
⑷某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法。某氧化还原滴定的反应体系中有反应物和生成物共六种,MnSO4、KMnO4、K2SO4、H2SO3、H2SO4、H2O,其中H2SO3的还原性最强,KMnO4 的氧化性最强。对此反应体系:
(1)被氧化的元素是_______;发生还原反应的过程是________→______。
(2)请用这六种物质组织一个合理的化学反应,写出它的离子方程式:_______
(3)反应中H2 SO4 是_______ (填编号)
A,氧化剂B.氧化产物 C.生成物 D.反应物
(4)当有20mL 0.1mol/L的氧化剂参加反应时,电子转移数目是_______ 。
(5)用标准KMnO4 溶液滴定H 2 SO3 时,滴定终点时颜色变化是_______。
(6)滴定过程中.下列图像所表示的关系正确的是_______(填编号)。 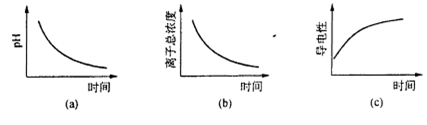
在葡萄糖、蔗糖、麦芽糖、淀粉、纤维素中,属于单糖的是 ,属于多糖的是 ;本身能发生银镜反应的有 ;只有水解后才可以发生银镜反应的二糖是 。
合理膳食,保持营养均衡,合理使用药物是青少年学生健康成长的重要保证。
①维生素C能增强人体对疾病的抵抗能力,促进人体生长发育。在氯化铁溶液中加入维生素C溶液后,溶液由黄色转变为浅绿色,说明维生素C具有________性。
②________(填字母)具有止咳平喘作用,可用于治疗支气管哮喘、鼻粘膜充血引起的鼻塞等。
a.麻黄碱 b.阿司匹林 c.抗酸药 d.青霉素
③人们每天摄取的热能中大约有75%来自糖类,淀粉是一种重要的多糖,它在人体内水解的最终产物是________(填分子式)。碘元素是人体必需的微量元素之一,有“智力元素”之称,目前,我国通过在食盐中加入________(填化学式)从而达到补碘的效果。生物制药中往往涉及到活性蛋白质的提纯,可以采用的一种方法是________(填“过滤”、“高温蒸馏”或“盐析”)。淀粉、纤维素、油脂、蛋白质中不属于天然高分子的是____________。
(1)维生素C是一种水溶性的维生素,缺乏VC会使人患上 病。切取一片新鲜水果,向切面上滴加淀粉溶液和碘水,若出现 ,说明新鲜水果中含有VC,这是利用VC具有 (填“氧化”或“还原”)性质。
(2)经科学测定,人体平均含氧65%,含碳18%,含氢10%(以上均为质量分数),则三种元素中原子数目最多的是 (填元素符号)。
(3)某品牌抗酸药的主要成分有糖衣、氢氧化铝、淀粉。写出该抗酸药发挥功效时的离子方程式: 。
某有机物A化学式为CxHyOz,15 g A完全燃烧可生成22 g CO2和9 g H2O。试求:
(1)该有机物的最简式 ;
(2)若A的相对分子质量为60且和Na2CO3混合有气体放出,A和醇能发生酯化反应,则A的结构简式为 ;
(3)若A的相对分子质量为60且是易挥发有水果香味的液体,能发生水解反应,则其结构简式为______ ;
(4)若A分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为 。