下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一。 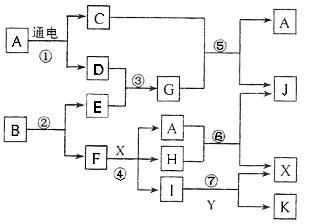
 请按要求填空:(1)写出A的电子式 、F元素在周期表位置 (2)反应⑤的化学方程式为: 。
请按要求填空:(1)写出A的电子式 、F元素在周期表位置 (2)反应⑤的化学方程式为: 。
(3)常温下,G和X反应生成Z,写出0.1mol/L Z溶液中离子浓度由大到小的顺序是 。
(4)1mol B通过反应②得到1mol F,B中F的质量分数为72%,则B的化学式为 。
(共10分)镁及其合金是一种用途很广的金属材料,海水中镁的含量为1.10 mg·L-1,目前世界上60%的镁是从海水中提取的。主要步骤如下: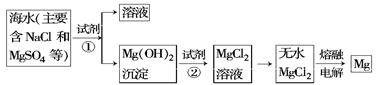
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用______。(填写名称)
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的操作方法是____________。
(3)试剂②可以选用________,其反应的离子方程式为_______________。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式________________。
(共4分)已知在Ca3(PO4)2的饱和溶液中存在平衡:
Ca3(PO4)2(s)  3Ca2+(aq)+2PO43-(aq)
3Ca2+(aq)+2PO43-(aq)
(1)溶度积Ksp=______________________;
(2)若一定温度下,饱和溶液中c(Ca2+)=2.0×10-6 mol·L-1,
c(PO43-)=1.58×10-6 mol·L-1,则Ksp=________________。
(共8分)已知A为金属单质,根据下列变化完成以下问题: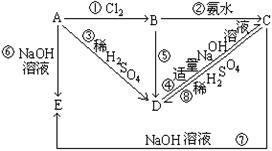
(1)写出对应化学式 DE
(2)写出以下反应的化学方程式
反应②
反应⑦
(共4分)
(1)25℃时,水的离子积常数KW为1.0×10—14;在pH=2的稀硫酸中,c(OH—) =;若升高温度,会使KW 数值(填“增大”、“减小”或“不变”)。
(2)在醋酸水溶液中存在平衡CH3COOH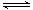 CH3COO—+H+。若分别改变下列条件:①加水稀释 ②加热 ③加少量固体醋酸钠,其中能使醋酸电离程度增大的是,能使溶液pH增大的是(填序号)。
CH3COO—+H+。若分别改变下列条件:①加水稀释 ②加热 ③加少量固体醋酸钠,其中能使醋酸电离程度增大的是,能使溶液pH增大的是(填序号)。
(共4分)写出下列物质在水中电离的方程式:
(1)NaHSO4在水中电离的方程式___________________
(2)H2CO3电离方程式______________________(只写第一步电离)