用于制作防弹背心材料的聚合物A,其结构为: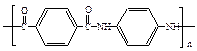 ,下列是由化合物B(分子式:C8H10)制备该聚合物的一种方案:
,下列是由化合物B(分子式:C8H10)制备该聚合物的一种方案: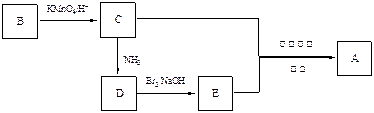
已知:
(1)写出B、D的结构简式:B 、D 。
(2)写出满足1H核磁共振谱的苯环上有两种氢,且能发生银镜反应的C的同分异构体(任写三个结构简式) 、 、 。
(3)C的上述一个同分异构体F,存在下列转化:
①写出F的结构简式 。
②用一个化学方程式表示由F 生成 G 和H过程中的第①步反应 。
③G与C能发生缩聚反应,写出该缩聚反应的化学方程式: 。
(I)下述反应中,属于氧化反应的是_______属于取代反应的是_______属于加成反应的是_______(填序号)
①乙醇与酸性重铬酸钾溶液的反应
②乙烷在光照条件下与氯气反应
③乙烯使酸性高锰酸钾溶液褪色
④乙烯使溴水褪色
⑤苯与浓硝酸浓硫酸混合共热制取硝基苯
⑥油脂在酸或碱催化条件下的水解反应
⑦苯在一定条件下与氢气的反应
(II)苹果酸  常用于汽水、糖果的添加剂
常用于汽水、糖果的添加剂
(1)写出苹果酸中官能团的名称_____________________
(2)写出苹果酸分别与下列物质反应的化学方程式(有机物用结构简式表示)
①与Na的反应______________________________________________
②与Na2CO3的反应__________________________________________
(III)写出实现下列转化的化学方程式(有机物用结构简式表示)
乙醇的催化氧化_______________________________________________
制乙酸乙酯___________________________________________________
A、B、C、D 四种主族元素原子序数均在20以内,A元素所处的周期数、主族序数、原子序数均相等,B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3 ,C元素原子的最高正价为+6价,C的阴离子与D的阳离子具有相同的电子排布,D可与C形成化合物D2C。
(1)D元素的名称_______;B在周期表中的位置:第_______周期第_______族
(2)A、B形成的化合物以_______共价键相结合(填极性或非极性)
(3)以C的最高价氧化物对应的水化物作为电解质溶液,组成氢氧燃料电池,放电时则负极区溶液的pH_______(填增大、减小、不变)
(4)以D的最高价氧化物对应的水化物作为电解质溶液,组成氢氧燃料电池,则正极的电极反应式为_____________________
(5)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示)____________________________
(6)C的质子数和中子数相等,则C 的原子组成符号为_______它形成的氢化物的还原性_______氯化氢(填强于或弱于)
(1)在一密闭的2 L的容器里充入8 mol SO2和4 mol18O2,在一定条件下开始反应:
2SO2(g)+O2(g) 2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答:
2SO3(g)2 min末测得容器中有7.2 mol SO2。试回答:
①反应后18O原子存在于哪些物质中________
②2 min末SO3的浓度为________
③用O2的浓度变化表示该时间段内的化学反应速率为________
(2)基本化工原料苯和乙烯,都有着十分广泛的用途。请回答:
①可以用来鉴别苯蒸气和乙烯的试剂是________(填序号)
A.水 B.溴的四氯化碳溶液 C.酸性高锰酸钾溶液 D.氢气
②苯分子具有平面正六边形结构,所有原子共平面,则苯分子中在一条直线上的原子最多有________个
(3)下列营养物质在人体内发生的变化及其对人的生命活动所起的作用不正确的是
A.人体中的糖类、油脂和蛋白质都能为人的生命活动提供能量
B.淀粉和纤维素 葡萄糖
葡萄糖 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂 甘油和高级脂肪酸
甘油和高级脂肪酸 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质 氨基酸
氨基酸 人体所需的蛋白质(人体生长发育、新陈代谢)
人体所需的蛋白质(人体生长发育、新陈代谢)
(1)海水中的钠盐、镁盐等都是重要的化工原料,从海水中提取铀、重水对一个国家来说具有战略意义。
①写出氯化镁的电子式__________________________
②重水的摩尔质量为____________________________
③写出金属镁的工业冶炼方程式__________________________________________
④海水淡化的常见方法有电渗析法、离子交换法、_________________
(2)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。
①乙烯和氯化氢在一定条件下反应的化学方程式是____________________________
②决定氯乙烷能用于冷冻麻醉应急处理的具体性质是________(填选项)
| A.沸点低 | B.沸点高 | C.易挥发 | D.难挥发 |
③甲烷与氯气光照下反应生成产物共________种
(3)“可燃冰”是天然气与水相互作用形成的晶体物质,若把“可燃冰”(用甲烷表示)燃烧在一定条件下改装成原电池,则在原电池的负极发生反应的物质是
化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们喜爱的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如图所示反应。
试写出:
⑴ 化合物的结构简式:
A____________ B___________ D____________
⑵反应类型:
A→E:______________ A→F :______________
⑶化学方程式:A→E__________; A→F_______________