(1)钒触媒(V2O5)能加快SO2的氧化速率,此过程中SO2先与V2O5反应生成V2O4。该过程的化学方程式可表示为__________________________________________。
(2)为测定过程中混合气的SO2体积分数,选用0.0500 mol/L I2的标准溶液、淀粉溶液进行测定。已知:V(耗用I2标准溶液)="10.00" mL,V(采集烟气)="100.0" mL(已折算为标准状况),则烟气中SO2 的体积分数为_____________________。
(3)一定温度时,SO2的平衡转化率(α)与体系总压强(p)的关系如图9所示。试分析工业生产中采用常压的原因是____________________。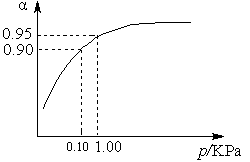
图9
(4)在温度相同、体积均为1 L的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH ="-98.3" kJ·mol-1。
2SO3(g) ΔH ="-98.3" kJ·mol-1。
| 容 器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
2 mol SO2、1 mol O2 |
2 mol SO3 |
m mol SO2、n mol O2、 p mol SO3 |
| c(SO3) /mol·L-1 |
1.4 |
1.4 |
1.4 |
| 能量变化 |
放出a kJ |
吸收b kJ |
吸收c kJ |
| SO2或SO3的转化率 |
α1 |
α2 |
12.5% |
则:α1+α2=_________________,p=________________mol,b+c=_______________kJ。
Ⅰ. A、B、C、D、E、F、G七种元素,试按下列所给条件推断,
①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;
②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气体
④G是除氢外原子半径最小的元素
(1)A 的名称是,B位于周期表中第周期第族。
(2)C的原子结构示意图是,
A元素与D元素形成化合物的电子式是。
(3)F的元素符号是。
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是,酸性最强的化学式是,气态氢化物最稳定的化学式是。
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是
。
Ⅱ、(1)下表中的实线表示元素周期表部分边界,请用实线画出周期表未完成的边界及金属元素与非金属元素的分界线。
(2)把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)
② 气态氢化物最稳定的非金属元素
写出下列反应的化学方程式
(1)乙烯和溴的四氯化碳溶液的反应__________________________。
(2)乙醇与红热的铜丝反应得到乙醛。
(3)乙酸乙酯与氢氧化钠反应_________________________________________。
⑴衣服上沾有动、植物油污,用水洗不掉,但可用汽油洗去,这是因为大多数有机物难溶于
而易溶于。有机化工厂附近严禁火种,这是因为绝大多数有机物。
(2)聚氯乙烯是一种(填“有”或“无”)毒塑料,工业上用乙炔(CH≡CH)和氯化氢在催化剂作用下发生反应制取氯乙烯,氯乙烯再经过反应制取聚氯乙烯。
锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。
某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
(1)酸洗时,为使水垢尽可能溶解,不宜选用的是 (填标号)。
| A.醋酸 | B.盐酸 | C.硝酸 | D.稀硫酸 |
(2)不溶物用碳酸钠溶液浸泡时,反应的离子方程式是 。
(3)洗出液中的Fe3+会腐蚀铁质管道,反应的离子方程式是 ,因此,常在洗出液中加入具有强还原性的SnCl2溶液,反应中的Sn2+与Fe3+的物质的量之比为1∶2,Sn2+转化为 (填离子符号)。
(4)柠檬酸(用H3R表示)可用作酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图
所示。图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 。
调节柠檬酸溶液的pH=4,有利于除去水垢中的氧化铁。pH=4时,溶液中上述4种微粒含量最多的是 。
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。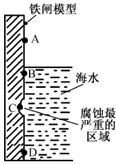
①该电化腐蚀称为。
②图中A和B区域相比较,腐蚀较慢的是(填字母)。
(2)实验室经常用到FeCl3溶液,在配制FeCl3溶液时常需加入少量的;将FeCl3溶液和碳酸氢钠溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为。
(3)已知t℃时,反应FeO(s)+CO(g) Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。
①t℃时,反应达到平衡时n(CO2):n(CO)=
②若在1L密闭容器中加人0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时
FeO(s)转化率为50%,则x=。