已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法:
I.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬。具体流程如下:
有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式__________________。
(2)还原+6价铬还可选用以下的________________试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
II.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式______________________________________。
(5)电解法中加入氯化钠的作用是:_______________________________________。
药物阿莫西林能杀灭或抑制细菌繁殖,它的合成路线如下: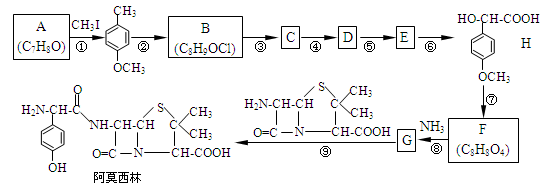
已知: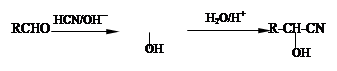
A能使三氯化铁溶液显色。
完成下列填空:
(1)写出A的结构简式:_______________;CH3I的作用_____________________。
(2)写出反应类型:反应②____________,反应⑤______________。
(3)G中官能团的名称_______________。
(4)反应④的化学方程式______________________________________。
H的一种同分异构体的一氯代物的结构为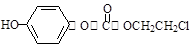 ,该物质在NaOH水溶液中加热反应时的化学方程式为 。
,该物质在NaOH水溶液中加热反应时的化学方程式为 。
(5)试写出能同时满足以下条件H所有的同分异构体 。
a.能与氯化铁溶液发生显色反应 b.能与碳酸氢钠反应产生无色气泡
c.取0.1mol有机物能与足量Na反应能产生3.36L(标况下)气体
d.苯环上的一氯代物只有两种,但苯环上氢原子数不少3
e.分子中含有甲基
(6)试利用CH3CH=CH2为原料制备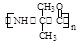 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图例如下:
某金属(A)在TK以下晶体的基本结构单元如左下图所示,T K以上转变为右下图所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同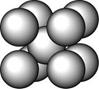
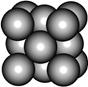
(1)在T K以下的纯A晶体中,与A原子等距离且最近的A原子数为______个;在T K以上的纯A晶体中,与A原子等距离且最近的A原子数为___________;
(2)纯A晶体在晶型转变前后,二者基本结构单元的边长之比为(TK以上与TK以下之比)___________。
(3)左上图的的堆积方式为 , TK以下经测定其结构和性质参数如下表所示
| 金属 |
相对原子质量 |
分区 |
原子半径/pm |
密度/g·㎝-3 |
原子化热/kJ·mol-1 |
| Na |
22.99 |
s区 |
186 |
0.960 |
108.4 |
| A |
60.20 |
d区 |
r |
7.407 |
7735 |
则r= pm,试解释该晶体金属原子化热很高的原因
。
(已知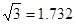 ,7.407≈
,7.407≈ ,1pm=10
,1pm=10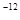 m)
m)
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长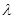 与光的频率v的关系为
与光的频率v的关系为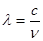 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
。(未说明原因不给分)
| 共价键 |
C—C |
C—N |
C—S |
| 键能/kJ·mol-1 |
347 |
305 |
259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5) [Cu(NH3)4]SO4中存在的化学键类型有(填序号)。
A.共价键 B.氢键 C.离子键 D.配位键 E.分子间作用力
NH3分子的空间构型为 ,属于 分子(填“极性”或“非极性”)
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大。A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。 A和C的氢化物沸点大小关系为 ,原因为
(2)D与E的原子化热分别为340 kJ·mol-1和400kJ·mol-1,则它们的熔点:D E(填“>”、“<”、“="”" )。
(3)分子A2B2中键与键之间的夹角为180°,并有对称性,为非极性分子,每个原子最外层电子数均满足八电子,其结构式为_____________,1mol该分子中含有 键的数目为 。
键的数目为 。
(4)基态E原子的外围电子排布式为 。EO2Cl2熔点:-96 .5℃,沸点:117℃,则固态EO2Cl2属于晶体。
(5)D的氢化物的晶体结构如图所示,其化学式是 。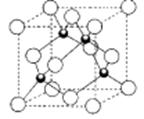
(1)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示,
则该反应为反应(填“吸热”或“放热”)
若已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 |
C—H |
O—H |
C=O |
H—H |
| 吸收热量(kJ/mol) |
a |
b |
c |
d |
则该反应吸收或放出热量为kJ(用含a b c d字母的代数式表示)
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生
CH4(g)+ 2H2O(g)  CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则 ① 前4s以H2O(g)浓度变化表示的平均反应速率为多少?②4s时,混合气体中H2的体积分数为多少?③ 平衡时,CH4的浓度是多少?
(要求:写出计算过程)