A、B、C、D四种可溶性化合物,分别由阳离子Na+、Al3+、Ba2+、Fe3+和阴离子Cl-、CO32-、OH-、SO42-中的各一种组成(离子不重复)。现做如下实验:
①A和B的溶液都显碱性,在A溶液中加入过量盐酸有无色气体产生;
②在C的溶液中加入KSCN溶液,溶液颜色发生变化;
③在D的溶液中加入B的溶液有白色沉淀生成,加入过量B的溶液,白色沉淀部分消失。
(1)根据以上实事推断化学式:A ,B  ,C ,D 。
,C ,D 。
(2)写出③的离子方程式 。
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据图1提供的信息,写出该反应的热化学方程式: ,在图1中曲线 (填“a”或“b”)表示加入铁触媒的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是 。
A.3v(H2)正=2v(NH3)逆
B.单位时间内生成n mol N2的同时生成2n mol NH3
C.混合气体的密度不再改变
D.容器内压强不随时间的变化而变化
(3)一定温度下,向2 L密闭容器中充入1 mol N2和3 mol H2,保持体积不变,0.5 min后达到平衡,测得容器中有0.4 mol NH3,则平均反应速率v(N2)= ,该温度下的平衡常数K= 。若升高温度,K值变化 (填“增大”、“减小”或“不变”)。
(4)为了寻找合成NH3的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 |
T(℃) |
n(N2)/n(H2) |
p(MPa) |
| ⅰ |
450 |
1/3 |
1 |
| ⅱ |
|
|
10 |
| ⅲ |
480 |
|
10 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应N2(g)+3H2(g) 2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
2NH3(g)的特点,在给出的坐标图2中,画出其在1 MPa和10 MPa条件下H2的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
Ⅰ.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解,则化学方程式为 。
其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命。以处理过的铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极反应式为 。
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,化学反应为:2Al+3Ag2O+2NaOH+3H2O 2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
2Na[Al(OH)4]+6Ag, 则负极的电极反应式为
,正极附近溶液的pH (填“变大”、“不变”或“变小”)。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式:(ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
| A.增大压强 | B.增大反应物的浓度 |
| C.使用催化剂 | D.降低温度 |
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题:黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 mol FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题: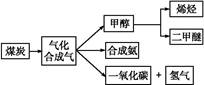
Ⅰ.已知该产业链中某反应的平衡常数表达式为:K=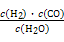 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:
。
Ⅱ.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0 MPa,温度230~280 ℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
ΔH1="-90.7" kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ΔH2="-23.5" kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH3="-41.2" kJ·mol-1
(1)写出催化反应室中三个反应的总反应的热化学方程式:。
(2)在某温度下,2 L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2 mol和6 mol,3 min后达到平衡,测得CO的转化率为60%,则3 min内CO的平均反应速率为 。若同样条件下起始时CO物质的量为4 mol,达到平衡后CH3OH为2.4 mol,则起始时H2为 mol。
(3)下列有关反应③的说法正确的是 。
A.在体积可变的密闭容器中,在反应③达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变
B.若830 ℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0
C.某温度下,若向已达平衡的反应③中加入等物质的量的CO和H2O(g),则平衡右移、平衡常数变大
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,实验结果如图,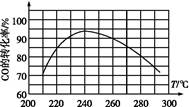
则CO转化率随温度变化的规律是 。
其原因是 。
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)已知在25 ℃、101 kPa时,C(s)、H2(g)和CO(g)燃烧的热化学方程式分别为:
C(s)+O2(g) CO2(g) ΔH1="-393.5" kJ/mol;
CO2(g) ΔH1="-393.5" kJ/mol;
H2(g)+ O2(g)
O2(g) H2O(g) ΔH2="-241.8" kJ/mol;
H2O(g) ΔH2="-241.8" kJ/mol;
CO(g)+ O2(g)
O2(g) CO2(g) ΔH3="-283.0" kJ/mol;
CO2(g) ΔH3="-283.0" kJ/mol;
①则C(s)+H2O(g) CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。
CO(g)+H2(g) ΔH= ,该反应平衡常数的表达式为K= ;升高温度,则K值 (填“变大”、“变小”或“不变”)。
②如果①反应在容积不变的密闭容器中进行,当反应达到平衡时 (填编号)。
a.v正(CO)∶v逆(H2)=1∶1
b.碳的质量保持不变
c.v正(CO)=v逆(H2O)
d.容器中的压强不变
③在容积不变的密闭容器中进行①反应,可以使c(CO)增大的是 。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2(g)从体系中分离出来
d.加入催化剂
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下2组数据:
CO2(g)+H2(g),得到如下2组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
|||
| 1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
①实验1中以v(CO2)表示的反应速率为 。
②向实验2的平衡混合物中再加入0.4 mol H2O(g)和0.4 mol CO2,达到新平衡时CO的转化率 (填“变大”、“变小”或“不变”)。
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH="-196.6" kJ/mol。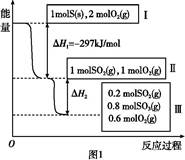

请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:。
(2)ΔH2= 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为 。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
a.升高温度
b.充入He气
c.再充入1 mol SO2(g)和1 mol O2(g)
d.使用催化剂
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。