甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:
CO (g) + 2H2(g)  CH3OH (g) △H 1 (反应1)
CH3OH (g) △H 1 (反应1)
该反应的原料CO和H2本身都可作为燃料提供动力,已知这两种物质燃烧的热化学方程式为: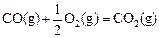 △H2=-283 kJ·mol-1 (反应2)
△H2=-283 kJ·mol-1 (反应2)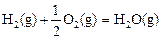 △H3=-242 kJ·mol-1 (反应3)
△H3=-242 kJ·mol-1 (反应3)
某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C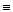 O O |
H-O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
1072 |
463 |
请回答下列问题:
(1)反应1的焓变△H1= 。
(2)CH3OH (g)燃烧生成CO2(g)和H2O(g)的热化学方程式为:
CH3OH(g)+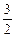 O2(g) ="=" CO2(g)+2H2O(g) △H4
O2(g) ="=" CO2(g)+2H2O(g) △H4
该反应的焓变△H4= 。
与CO和H2相比,甲醇作为汽车动力燃料的优点是 。
(3)反应1的平衡常数表达式为 。
为提高甲醇的产率,可以采取的措施有 (写出3点)。既能提高产率,又能提高反应速率的措施是 。
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:CH3OH(l)+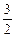 O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g) ="=" CO2(g)+2H2O(l)。其工作原理示意图如下: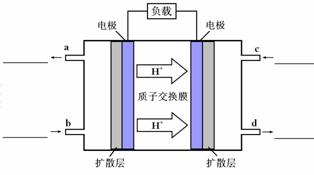
①在上图的横线上标出a、b、c、d四个出入口通入或排出的物质名称(或化学式)
②负极的电极反应式为 。
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为。
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K=。若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将移动(填“向左”、 “向右”或“不”)。
N2(g)+2CO2(g);△H<0。若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K=。若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将移动(填“向左”、 “向右”或“不”)。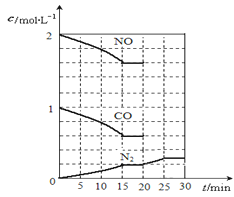
20min时,若改变反应条件,导致N2浓度发生如图11所示的变化,则改变的条件可能是
(填序号)。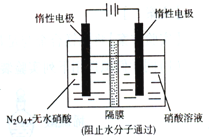
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式。
(4)如图所示装置可用于制备N2O5,则生成N2O5的那一极电极反应式为。
聚合氯化铝是新型、高效絮凝剂和净水剂,其单体是液态碱式氯化铝[Al2(OH)nCl6-n],工业上常采用铝盐溶液部分水解制备碱式氯化铝,其工艺流程如下: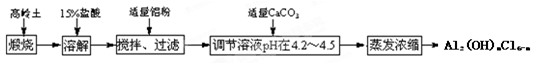
已知:高岭土:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)及少量杂质和水。
①Al3+以氢氧化物形式完全沉淀时,溶液的pH为5.2。
根据流程图回答下列问题:
(1)写出溶解过程中反应的离子方程式、;
(2)加适量铝粉的主要目的是 ;
(3)溶液的pH需控制在4.2~4.5的原因是;
(4)“蒸发浓缩”需保持温度在90~100℃,控制该温度的操作名称是 ,写出该过程反应的化学方程式。
A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。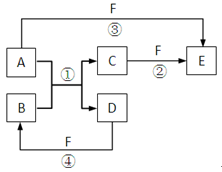
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是:。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是:。
(3)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,B的结构式是:;反应④的化学方程式是:。
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如右图所示的变化: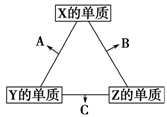
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在元素周期表中的位置是。
(2)C在一定条件下反应生成A的化学方程式是。
(3)X、Y、Z三种元素可组成一种强酸W,C能被W溶液吸收生成一种盐,该盐的水溶液的pH小于7,其原因是(用离子方程式表示):。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,ΔH<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是(填写各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大
A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。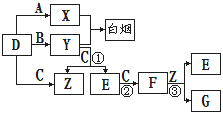
请回答下列问题:
(1)D的化学式为、Y的化学式为、E的化学式为. (2)反应③的离子方程式为。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为
(4)0.1 mol·L-1的X溶液和0.1 mol·L-1的Y溶液等体积混合,溶液呈___性(填“酸”、“碱”或“中”),原因是_____________(用离子方程式说明)。