I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为 ,其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”),冰晶石的作用为 。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”)。
已知:①2Al(s)+3Cl2(g)=2AlCl3(s) △H1=-1390 .8kJ/mol
②4Al(s)+3O2(g)=2Al2O3(s) △H2=-3339.6kJ/mol
③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
Al2O3(s)+ 3C(s)+3Cl2(g)=2AlCl3(s)+3CO(g)的△H= 。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为 在一定温度下,
在一定温度下,
将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
| A.增大压强 | B.增大反应物的浓度 | C.使用催化剂 | D.降低温度 |
Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2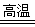 6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示,铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
有A、B、C、D四种化合物,其中A、C、D为盐且焰色反应均为黄色,而B是碱且透过钴玻璃观察焰色反应为紫色,A、C和盐酸反应均得到D的溶液,将固体C加热可得到A,若在A的溶液中通入一种无色无味气体,又可制得C,若B的溶液滴加到硫酸铜中溶液会出现蓝色沉淀E。试推断(写化学式)
A:________、B:________、C:_________、D:_________、E:
(1)在氧化还原反应中,化合价升高的物质,电子,被,做 剂,
化合价降低的物质, 电子,被,做剂,
(2)则在反应Fe2O3 + 3CO ="==" 2Fe + 3CO2中,是氧化剂,是还原剂,元素被氧化,元素被还原;是氧化产物,是还原产物。则每1mol Fe2O3参加反应转移的电子数目为:
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
① Na2SO4 + 4C →高 温 Na2S + 4CO
② Na2SO4 + 4 CO→高 温 Na2S + 4CO2
(1)现要制取Na2S 7.8克,需要无水芒硝(Na2SO4)g;
(2)若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量范围n的范围是< n < ;
(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为 y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经被部分氧化的硫化钠39.2 g溶于水中,加入足量盐酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况),求:39.2g被部分氧化的硫化钠中Na2S的物质的量为mol;Na2SO3的物质的量为mol;Na2SO4的物质的量为mol。
有机物的结构可用“键线式”简化表示,如:CH3—CH=CH—CH3可表示为 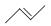 ,有一种有机物X它的键线式如下:
,有一种有机物X它的键线式如下: 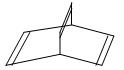
(1) X的分子式为:;有机物Y是X的同分异构体,且属于芳香族化合物。则Y的结构简式是。
(2) Y可以与溴水反应,其生成物的结构简式是; Y在一定条件下还可生成高分子化合物,该反应的化学方程式:。
(3) Y在一定条件下还可以与H2生成环状的饱和烃Z,Z的结构简式为。
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行: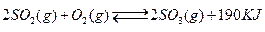
1)该反应所用的催化剂是(填写化合物名称),该反应450℃时的平衡常数500℃时的平衡常数(填“大于”、“小于”或“等于”)。
2)该热化学反应方程式的意义是.
3)下列描述中能表明该反应已达平衡状态的是。
a.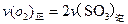 b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则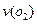 =mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,mol<n(SO3)<mol。
=mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,mol<n(SO3)<mol。