将等体积的甲烷与氯气混合于一集气瓶中,加盖后置于光亮处,下列有关此实验的现象和结论叙述不正确的是( )
| A.瓶中气体的黄绿色逐渐变浅 |
| B.瓶内壁有油状液滴形成 |
| C.若日光直射,可能发生爆炸 |
| D.生成物只有一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷 |
化学与生产和生活密切相关,下列说法正确的是
| A.聚乙烯塑料的老化是因为发生了加成反应 |
| B.煤经过气化和液化等物理变化可转化为清洁燃料 |
| C.合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
| D.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
有机物X和Y可作为“分子伞”给药物载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)
下列叙述错误的是()
| A.1molX在浓硫酸作用下发生消去反应,最多生成3molH2O |
| B.1molY发生类似酯化的反应,最多消耗2molX |
| C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3 |
| D.Y与癸烷的分子链均呈锯齿形,但Y的极性较强 |
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得: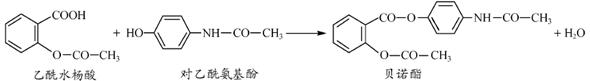
下列有关叙述正确的是()
| A.贝诺酯分子中有三种含氧官能团 |
| B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 |
| D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
某单官能团有机化合物,只含碳、氢、氧三种元素,相对分子质量为58,完全燃烧时产生等物质的量的CO2和H2O。它可能的结构共有(不考虑立体异构)()
| A.4种 | B.5种 | C.6种 | D.7种 |
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
下列有关香叶醇的叙述正确的是()
| A.香叶醇的分子式为C10H18O | B.不能使溴的四氯化碳溶液褪色 |
| C.不能使酸性高锰酸钾溶液褪色 | D.能发生加成反应不能发生取代反应 |