将标准状况下的HCl气体4.48 L溶于水形成100 mL溶液,然后与足量的铁屑充分反应。计算:(1)所得盐酸溶液的物质的量浓度。
(2)参加反应的铁的质量。
(3)生成的H2的体积(标况)。
(4)将生成的FeCl2配成400 mL溶液,此溶液中FeCl2的物质的量浓度是多少?
将Na2CO3和NaHCO3混合物19 g,充分加热后,收集到CO2有1.12 L(标准状况),冷却后将剩余固体溶于300 mL水中,配为一定浓度的溶液。求:
(1)原混合物中Na2CO3的质量。
(2)所配制的溶液的物质的量浓度。
某学生用NaHCO3和KHCO3组成的某化合物进行试验,测得如下数据(盐酸的物质的量浓度相等):
| 实验编号 |
① |
② |
③ |
| 盐酸体积 |
50mL盐酸 |
50mL盐酸 |
50mL盐酸 |
| m(混合物) |
9.2g |
16.56 g |
27.6 g |
| V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
根据表中数据试计算:
(1)盐酸的物质的量浓度。
(2)混合物中NaHCO3的质量分数。
氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) 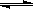 CO2(g)+ H2(g); △H<0。在850℃时,K=1。
CO2(g)+ H2(g); △H<0。在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K▲1(填“大于”、“小于”或“ 等于”)
等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、
1.0mol CO2和 x mol H2,则:
①当x=5.0时,上述平衡向▲(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是▲。
(3)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a▲b(填“大于”、“小于”或“等于”)。
向一定量的Fe、FeO、Fe2O3混合物中加入1.00mol/l的盐酸100ml,可恰好使混合物完全溶解,放出224ml标准状况下的气体,向所得溶液中加入硫氰化钾,无血红色出现。
(1)若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量是多少?
(2)求原混合物中铁元素的质量分数 。
取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00 mol·L-1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100 mol·L-1 Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00 mol·L-1盐酸恰好完全中和。计算混合物中各物质的质量。