分类法在化学的发展中起到非常重要的作用,下列分类标准合理的是
①根据氧化物的组成元素将氧化物分成酸性氧化物碱性氧化物和两性氧化物
②根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否有丁达尔效应将分散系分为溶液胶体和浊液
④根据反应中的热效应将化学反应分为放热和吸热反应
⑤根据水溶液能否导电将化合物分为电解质和非电解质
| A.④② | B.②③④ | C.①③⑤ | D.⑤④①② |
下列各溶液中,微粒的物质的量浓度关系正确的是()
| A.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合: [Cl-]=[Na+]>[H+]>[OH-] |
| B.0.1mol/L pH=4的NaHB 溶液中:[HB-]>[H2B]>[B2-] |
| C.在NaHA溶液中一定有[Na+]+[H+]=[HA-]+[OH-]+[A2-] |
| D.[NH4+]相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液: |
[(NH4)2SO4]<[(NH4)2CO3]<[NH4Cl]
下列叙述正确的是( )
| A.将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH的别为a和a+1,则c1=10c2 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
| D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大 |
下列反应的离子方程式错误的是()
| A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合 Ba2+ + 2 OH—+ NH4+ + HCO3—= BaCO3↓ + NH3·H2O + H2O |
| B.澄清石灰水与少量小苏打溶液混合 Ca2++OH—+HCO3—= CaCO3↓+H2O |
| C.硫酸铝溶液和小苏打溶液反应 Al3++3 HCO3—= 3 CO2↑+Al(OH)3↓ |
| D.氯化铝溶液中加入过量的氨水 Al3++4NH3·H2O = [Al(OH)4]—+4NH4+ |
蓄电池是一种可反复充电、放电的装置。它放电时起原电池的作用,将化学能转变为电能;而充电时电解池的作用,将电能转变为化学能贮存起来。某蓄电池充电和放电时发生的反应为:Fe + NiO2 + 2H2O Fe(OH)2 + Ni(OH)2关于此蓄电池有下列说法:
Fe(OH)2 + Ni(OH)2关于此蓄电池有下列说法:
①放电时,NiO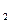 为正极;
为正极;
②②充电时,阳极反应式为:Fe(OH)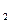 +2e-→ Fe+2OH
+2e-→ Fe+2OH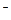 ;
;
③放电时,电解质溶液中的阳离子向正极方向移动;
④充电时,Ni(OH) 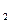 的反应式为:Ni(OH)
的反应式为:Ni(OH) 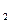 →NiO
→NiO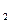 +2H
+2H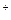 +2e-;
+2e-;
⑤蓄电池的电极必须浸在碱性电解质溶液中;错误的是
A。 ③ B。② C。①③⑤ D。 ②和④
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI + 3H2O KIO3 + 3H2↑。下列有关说法正确的是()
| A.电解时,石墨作阴极,不锈钢作阳极 |
| B.电解时,阳极反应是:I –+ 3H2O → IO3 – + 6H++ 6e – |
| C.阳极发生了还原反应 |
| D.电解前后溶液的pH明显减小 |