氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)如图是N2和H2反应生成2 mol NH3过程中能量变化示意图,写出生成NH3的热化学方程式:________________________________________________________________________。
(2)由气态基态原子形成1 mol化学键释放的最低能量叫键能。从化学键的角度分析,化
学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过
程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
已知反应N2(g)+3H2(g)  2NH3(g) ΔH=a kJ·mol-1。
2NH3(g) ΔH=a kJ·mol-1。
试根据表中所列键能数据估算a的数值:________。
| 化学键 |
H—H |
N—H |
N≡N |
| 键能kJ·mol-1 |
436 |
391 |
945 |
标准状况下,向1L1.0mol/LNaOH溶液中通入17.92LCO2,充分反应后溶液中的CO32-,HCO3-的物质的量浓度之比为:
| A.2∶1 | B.1∶2 | C.1∶3 | D.1∶4 |
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C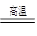 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中,每生成1molAlN需转移3mol电子 |
| C.AlN中氮元素的化合价为+3 |
| D.AlN的摩尔质量为41g |
向50ml 1mol/L的KAl(SO4)2溶液中逐滴加入2mol/L的Ba(OH)2溶液,充分反应。下列说法正确的是
| A.当Al3+恰好完全沉淀时,消耗Ba(OH)2溶液30ml |
| B.当SO42—恰好完全沉淀时,Al3+全部转化为AlO2— |
| C.加入50mlBa(OH)2溶液时,反应可用下列离子方程式表示: 2Al3++3SO42—+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓ |
| D.随加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
下列推断正确的是( )
| A.铝粉在氧气中燃烧生成Al2O3,故铁丝在氧气中燃烧生成Fe2O3 |
| B.铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜 |
| C.活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中 |
| D.钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属均作还原剂 |
已知反应M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为
| A.+2 | B.+3 | C.+4 | D.+6 |