下图为常温下用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1盐酸和20.00 mL 0.1000 mol·L-1醋酸的曲线。若以HA表示酸,下列判断和说法正确的是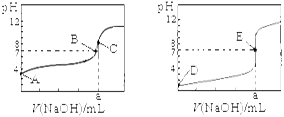
A.左图是滴定盐酸的曲线
B.E点时溶液中离子浓度为c(Na+) = c(A—)
C.B点时,反应消耗溶液体积:V(NaOH) <V(HA)
D.当0 mL< V(NaOH) < 20.00 mL时,对应溶液中各离子浓度大小顺序一定均为c(A-) >c(Na+)> c(H+) > c(OH-)
分析下表中各项的排布规律,有机物X是按此规律排布的第23项,下列有关X的组成、性质的说法中肯定错误的是
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| CH4 |
CH2O |
CH2O2 |
CH4O |
C2H6 |
C2H4O |
C2H4O2 |
C2H6O |
①是己酸②是己醇③是戊酸甲酯④在稀硫酸中易变质⑤一定能与钠反应
A.②⑤ B.①③④
C.③④ D.②③⑤
下列实验或操作能达到实验目的的是
下列有机物的命名正确的是
| A.3,4,4 -三甲基己烷 | B.2-甲基-4-乙基-1-戊烯 |
| C.2-乙基-1-戊烯 | D.2-乙基丁烷 |
下列化学用语正确的是
| A.1,2—二溴乙烷的结构简式:C2H4Br2 | B.羟基的化学式:OH- |
| C.己烷的分子式:C6H12 | D.乙烯分子的最简式:CH2 |
有机物CH3-CH=CH-Cl能发生的反应有( )
①取代反应②加成反应③消去反应④使溴水褪色
⑤使酸性KMnO4溶液褪色⑥与AgNO3溶液生成白色沉淀⑦聚合反应
| A.以上反应均可发生 | B.只有⑥不能发生 |
| C.只有⑦不能发生 | D.只有②不能发生 |