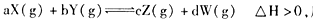 反应5min达到平衡时,X减小n mol·L-1,用Y表示的反应速率为0.6n mol·L-1·min-1。若将体系压强增大,W的百分含量不发生变化,则下列描述正确的是 ( )
反应5min达到平衡时,X减小n mol·L-1,用Y表示的反应速率为0.6n mol·L-1·min-1。若将体系压强增大,W的百分含量不发生变化,则下列描述正确的是 ( )
| A.升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
| B.反应中各物质的系数比a:b:c:d可能为1:3:2:2 |
| C.增大X的浓度,平衡向正反应方向移动,X和Y的转化率都增大 |
| D.增大压强和使用催化剂都不能改变该反应的速率和化学平衡状态 |
下列离子方程式错误的是
| A.钠投入硫酸铜溶液中:2Na+Cu2+===2Na++Cu |
| B.碳酸钙与盐酸反应:CaC03+2H+===Ca2++C02↑+H20 |
| C.硫酸与氯化钡反应:SO2-4+Ba2+===BaSO4↑ |
| D.氯气通人水中:Cl2+H20===H++Cl-+HCl0 |
已知NH4CuSO3与足量的10mol/L硫酸溶液混合微热,产生下列现象:
①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。
据此判断下列说法正确的是
| A.1mol NH4CuSO3完全反应转移0.5mol电子 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.反应中硫酸作氧化剂 |
设NA代表阿伏加德罗常数,下列说法中,正确的是
| A.2.3g金属钠全部变成钠离子时失去的电子数目为0.2NA |
| B.2g氢气所含的原子数目为NA |
| C.17gNH3所含的电子数为10NA |
| D.NA个氧分子和NA个氢分子的质量比等于16∶1 |
将5.1gMg、Al合金溶解在过量的500mL2mol/L的盐酸中,然后加入4mol/LNaOH溶液。若要使生成的沉淀最多,则应加入的这种NaOH溶液的体积是
| A.200mL | B.250 mL | C.425mL | D.560mL |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
| A.1 mol乙烷分子中含有共价键总数为7NA |
| B.1 mol甲基(—CH3)所含的电子总数为9NA |
| C.标准状况下,22.4L苯完全燃烧耗氧分子数为8.5NA |
| D.1 mol丁烷被氯气完全取代时消耗的氯分子数为10NA |