将Cu片放入0.1mol/L FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比
| A.3:2 | B.3:5 | C.4:3 | D.3:4 |
已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2 ,下列关于该反应的叙述不正确的是
| A.该反应中,氧化剂与还原剂物质的量之比为9:5 |
| B.当反应中有1mol电子转移时,被还原氯气物质的量为1/18 mol |
| C.每产生1mol O2时,被氧元素还原的氯气物质的量为2mol |
| D.参加反应的水有2/5被氧化 |
将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
| A.加入合金的质量不可能为5 g |
| B.参加反应的硝酸的物质的量为0.1 mol |
| C.沉淀完全时消耗NaOH溶液的体积为150 mL |
| D.溶解合金时收集到NO气体的体积在标准状况下约为2.24 L |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+ cCl2↑+ d HClO4 +eH2O。下列有关说法不正确的是
| A.还原产物只有Cl2 |
| B.若氯酸分解所得混合气体,lmol混合气体质量为45g,则反应方程式可表示为: 3HClO3 =2O2↑+ C12↑+ HClO4 + H2O |
| C.由非金属性Cl>S,可推知酸性HClO3>H2SO4 |
| D.若化学计量数a=8,b=3,则该反应转移电子数为20 |
如图中的两条线分别代表的是:1g C3H6 和1g M气体在相同容积的容器中,测得容器中的压强和温度的关系,试根据图形判断M气体可能是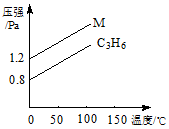
| A.C2H4 | B.C3H8 | C.H2S | D.N2O4 |
根据表中信息判断,下列选项正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4…… |
| ② |
C12、FeBr2 |
FeC13、FeBr3 |
| ③ |
MnO4-…… |
C12、Mn2+…… |
A.第①组反应的其余产物为H2O、MnSO4
B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成lmol Cl2,转移电子5mol
D.氧化性由强到弱顺序为MnO4一>Cl2> Fe3+> Br2