(6分)有一瓶澄清溶液,可能含有NH+4、K+、Mg2+、Ba2+、Al3+、Fe3+、SO2― 4、CO2― 3、NO― 3、Cl―、I―现进行如下实验:
(1)测知溶液显强酸性;
(2)取样加少量CCl4和数滴新制氯水,CCl4层为紫红色;
(3)另取样滴加稀NaOH溶液,使溶液变为碱性,此过程中均无沉淀生成;
(4)取少量上述碱性溶液,加Na2CO3溶液出现白色沉淀;
(5)将实验(3)中的碱性溶液加热,有气体放出,该气体能使湿红色石蕊试纸变蓝。
问:①原溶液中肯定存在的离子是____________________;
②肯定不存在的离子是______________________________;
③不能确定是否存在的离子是______________________________。
在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图所示A—E为实验室 常见的仪器装置(部分固定夹持装置略去),请根据要求
常见的仪器装置(部分固定夹持装置略去),请根据要求 回答问题。
回答问题。
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置中的 ▲ 。
(2)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是
▲ ,写出制纳米级碳酸钙的化学方程式: ▲ 。
(3)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级。
▲ 。
某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式: ▲。
(2)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)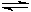 CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将▲(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2 t甲醇,至少需额外补充H2▲t。
(3)用甲醇—空气碱性(KOH)燃料电池作电源电解精炼粗铜(右图),
在接通电路一段时间后纯Cu质量增加3.2 g。
①请写出燃料电池中的负极反应式:▲。
②燃料电池正极消耗空气的体积是▲(标准状况,
空气中O2体积分数以20%计算)。
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:
Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示: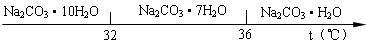
Ⅱ、25℃时有关物质的溶度积如下:
| 物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe (OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为:
▲。
25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的
pH=8时,c( M
M g2+):c(Fe3+)=▲。
g2+):c(Fe3+)=▲。
(2 )“趁热过滤”时的温度应控制在
)“趁热过滤”时的温度应控制在 ▲。
▲。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用。
请你分析实际工业生产中是否可行▲,并说明理由:
▲。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+ 53 2.36kJ·mol-1
2.36kJ·mol-1
Na2CO3·10 H2O (s)=Na2CO3·H2O(s)+9 H2O(g)△H=+ 473.63kJ·mol-1
(s)=Na2CO3·H2O(s)+9 H2O(g)△H=+ 473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式▲。
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
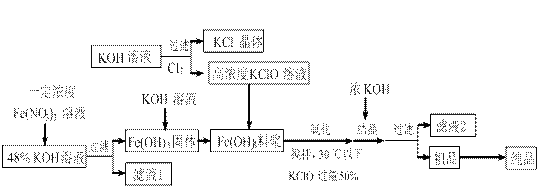
(1)在农业生产中,滤液1可用作 ▲。
▲。
(2)上述氧化过程中,发生反应的离子方程式是:▲,控制反应温度30℃以下的原因是:▲。
(3)结晶过程中加入浓KOH溶液的作用是:▲。
(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KCl O3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为▲。
O3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为▲。
(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在▲附近、反应时间应控制在▲。
活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO): 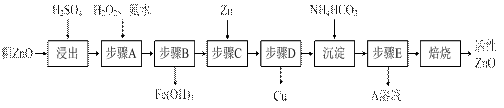
已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 |
Fe2+ |
Fe3+ |
Zn2+ |
Cu2+ |
| 开始沉淀时pH |
6.34 |
1.48 |
6.2 |
5.2 |
| 完全沉淀时pH |
9.7 |
3.2 |
8.0 |
6.4 |
请问答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是▲,该步骤需控制溶液pH的范围是▲。
(2)A溶液中主要含有的溶质是▲。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是:△S▲(选填“=”、“>”、“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓 度为▲mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
度为▲mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。