用18 mol/L浓硫酸配制100ml 3.0mol/L稀硫酸实验步骤如下:①计算所用硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是_________ml;
(2)所需要的仪器有:容量瓶(规格:__________)、量筒(规格:__________)
(从下列中选用填序号:A、10ml B、25ml C、500ml D、250ml E、100ml),
除此之外还需要的仪器有:____________________________________________________。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用偏高、偏低、无影响填写)
A、所用的溶解仪器未洗涤_________________;
B、容量瓶用蒸馏水洗涤后未干燥_________________;
C、所用的浓硫酸长时间放置在敞口容器内_________________;
D、定容时仰视溶液的凹液面_________________;
E、溶解后立即转移到容量瓶中定容_________________。
(12分)实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案: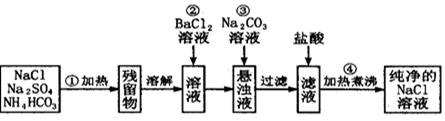
如果此方案正确,那么:
(1)操作①可选择_____仪器。
| A.烧瓶 | B.烧杯 | C.锥形瓶 | D.坩埚 E、蒸发皿 |
(2)操作②是否可改为加硝酸钡溶液?为什么?(填能或不能)理由
(3)进行操作②后,如何判断SO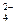 已除尽,方法是__________
已除尽,方法是__________
(4)操作③的目的是_________
为什么不先过滤后加碳酸钠溶液?理由是___________________。
(5)操作④的目的是____________________。
Ⅰ⑴用14.2g无水硫酸钠配制成500 ml溶液,其物质的量浓度为▲mol/L。
⑵若从上述溶液中取出10 ml,则这10 ml 溶液的物质的量浓度为▲mol/L,含溶质的质量为▲g。
⑶若将上述10 ml 溶液用水稀释到100 ml,所得溶液中Na+的物质的量浓度为▲mol/L;若将稀释后溶液中的SO42-全部沉淀下来,至少需要加入0.1 mol/L的BaCL2溶液
▲ml 。
Ⅱ现有36%的醋酸(CH3COOH),密度为1.04g/ml.,
欲配制0.1 mol/L的醋酸250 ml,需要取用36%的醋酸▲ml。
需要使用的实验仪器有烧杯、▲、▲、▲、▲,
若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度 ▲(填“正确”、“偏大”或“偏小”)。
▲(填“正确”、“偏大”或“偏小”)。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,为了检验SO2和C2H4的性质,有人设计下列实验方案。
(1)I、II、III、IV装置可盛放的试剂是I▲;II▲;III▲;IV▲(将下列有关试剂的序号填入空格内);
| A.品红溶液 | B.NaOH溶液 |
| C.浓H2SO4 | D.酸性KMnO4溶液 |
(2)能说明SO2气体存在的现象是▲;
(3)使用装置II的目的是▲;
(4)确定含有乙烯的现象是▲。
(5)如果Ⅳ盛放的溶液为溴水,那么发生的化学方程式为▲,反应类型为▲
如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。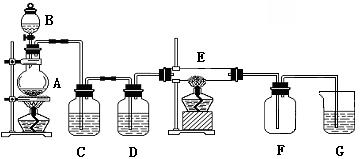
试回答:
(1)实验室制氯气的化学方程式:_______________________________;
(2)C装置的作用是________________;D 装置的作用是__________________;
E中发生化学反应的方程式为:_____________________________。
(3)烧杯G 中装有氢氧化钠溶液的作用是___________________;发生反应的化学方程式为:_______________________________________。
在酸碱中和滴定的操作中,用标准溶液润洗滴定管2—3次的目的是。判断滴定终点的现象是。若先用待测溶液润洗锥形瓶,则对滴定管结果的影响是。