已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强。它可用于制备苯甲酸乙酯和苯甲酸铜。
(一)制备苯甲酸乙酯
相关物质的部分物理性质如表格:
实验流程如下:
(1)制备苯甲酸乙酯,下列装置最合适的是 ,反应液中的环己烷在本实验中的作用 。
(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热。放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷。反应完成的标志是_______。
(3)步骤③碳酸钠的作用是 ,碳酸钠固体需搅拌下分批加入的原因 。
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥。乙醚的作用 。
(5)步骤⑤蒸馏操作中,下列装置最好的是________(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用 (水浴加热、直接加热、油浴加热)。
(二)制备苯甲酸铜
将苯甲酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2粉未,然后水浴加热,于70~80℃下保温2~3小时;趁热过滤,滤液蒸发冷却,析出苯甲酸铜晶体,过滤、洗涤、干燥得到成品。
(6)混合溶剂中乙醇的作用是_______________,趁热过滤的原因________________
(7)本实验中下列药品不能代替氢氧化铜使用的是_____________________
A.醋酸铜 B.氧化铜 C.碱式碳酸铜 D.硫酸铜
(8)洗涤苯甲酸铜晶体时,下列洗涤剂最合适的是________
A.冷水 B.热水 C.乙醇 D.乙醇水混合溶液
由于条件所限,仅有一大一小两支试管和稀硫酸,甲、乙两同学各找来铝制牙膏皮,
各自设计一种装置来制取一试管氢气。他们设计装置如图所示:
(1)上述两装置相比,____________(填“甲”或“乙”)装置设计更合理。
(2)用较合理的装置来制取氢气,现欲使氢气充满收集气体的试管,应采取的措施
是__________________________。
(3)还可以用哪些物品代替牙膏皮或稀硫酸来完成反应?___________(填写一种物质即可)。
 根据硫化氢气体的实验室制法和性质完成下列填空。
根据硫化氢气体的实验室制法和性质完成下列填空。
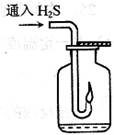
1. 若用启普发生器制取硫化氢气体,则制取气体的原料可选用。
若用启普发生器制取硫化氢气体,则制取气体的原料可选用。 a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁
a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁 c.稀硫酸与硫化钠 d.稀盐酸与硫化亚铁
c.稀硫酸与硫化钠 d.稀盐酸与硫化亚铁 2.现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器;(填编号)。
2.现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器;(填编号)。
 3.如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,
3.如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液, 点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察
点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察 的现象是。
的现象是。 4.在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
4.在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为: 反应过程中,溶液的
(填"变大"、"变小"或"不变")。
反应过程中,溶液的
(填"变大"、"变小"或"不变")。 5.点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是_。
5.点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是_。

 6.已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是_。
6.已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是_。
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如下图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为___________________________________。
(2)阴极上的电极反应式为___________________________________。
(3)原上层液体是___________________________________________。
(4)原下层液体是___________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是________________________________________。
(6)要检验上层液体中含有的金属离子,其方法是___________________________________,现象是________________________________________。
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如图418。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
图4-18
(1)阳极上的电极反应式为_______________________。
(2)阴极上的电极反应式为_______________________。
(3)原上层液体是______________________。
(4)原下层液体是______________________。
(5)搅拌后两层液体颜色发生变化的原因是_______________________。
(6)要检验上层液体中含有的金属离子,其方法是_______________,现象是_______________。
已知在pH为4—5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净CuSO4溶液的方法,并根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量。其实验流程如下:

图4-16
试回答下列问题:
(1)步骤①所加入的A的化学式为________________,加入A的作用是___________________,
(2)步骤②中所用部分仪器如图4-16所示,则A应接直流电源的__________极。
(3)电解开始后一段时间,在U形管内可观察到的现象是____________,其电解总反应的离子方程式为________________________。
(4)下列实验操作属必要的是__________(填字母,下同),属不必要的是________________。
| A.称量电解前电极的质量 |
| B.电解后电极在烘干、称量前,必须用蒸馏水冲洗 |
| C.刮下电解后电极上的铜,并清洗、称量 |
| D.电极在烘干称量的操作必须按烘干→称量→再烘干→再称量进行两次 |
E.在有空气存在的情况下,电极烘干必须采用低温烘干法
(5)铜的相对原子质量为______________________。