在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如下图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
(1)阳极上的电极反应式为___________________________________。
(2)阴极上的电极反应式为___________________________________。
(3)原上层液体是___________________________________________。
(4)原下层液体是___________________________________________。
(5)搅拌后两层液体颜色发生变化的原因是________________________________________。
(6)要检验上层液体中含有的金属离子,其方法是___________________________________,现象是________________________________________。
实验室制氨气通常有三种方法:①用固体氢氧化钙和氯化铵反应(装置同课本);②称取7.9 g碳酸氢铵固体放入试管内,再加入8 g氢氧化钠固体,常温下即能产生氨气(装置如下图中甲);③在锥形瓶中注入50 mL浓氨水,再加入10 g氢氧化钠固体(装置如下图中乙)。选取三个250 mL的干燥的烧瓶及瓶塞,用于收集三种制法的氨气。请完成下列问题: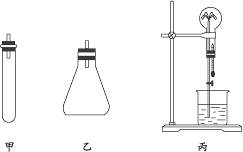
(1)写出用②法制取氨气的化学方程式:__________________________________________。
(2)说明用③法制取氨气的原理:________________________________________________。
(3)检验氨气已收集满的方法:__________________________________________________。
(4)用集满氨气的烧瓶做喷泉实验,装置如图中丙(烧杯内盛酚酞溶液),其现象是_____
_______________________________________________________________________________。
为了测定硫酸铵和氯化铵混合物中氯化铵的质量分数,甲、乙两位同学按下列实验步骤进行实验:称量样品→溶解→加过量试剂A→过滤出现沉淀B→洗涤沉淀→烘干称量→处理实验数据并得出结果。
(1)实验时,甲同学选用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A,其中同学所选的试剂A不合理,理由是________________。
(2)以下都是在试剂A选择正确时进行的实验:
①为进行称量、溶解、反应、过滤、洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码,烧杯、过滤器、铁架台及附件,胶头滴管、量筒,其中还缺少一件必备的仪器是_____________。
②若过滤所得沉淀未经洗涤烘干称量,测得结果将________(填“偏高”或“偏低”)。
③若实验测得混合物的质量为W g,沉淀物的质量为m g,实验测定的氯化铵质量分数计算式=_____________。
Ⅰ.合成氨工业对化学和国防工业具有重要意义。写出氨的两种重要用途_________________________________。
Ⅱ.实验室制备氨气,下列方法中适宜选用的是__________________。
①固态氯化铵加热分解
②固体氢氧化钠中滴加浓氨水
③氯化铵溶液与氢氧化钠溶液共热
④固态氯化铵与氧化钙混合加热
Ⅲ.为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图119中夹持装置均已略去)。
图1-9
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气产生。在F出口处收集氢气并检验其纯度。
②关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
完成下列问题:
(1)检验氢气纯度的目的是___________________________。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是__________________,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是___________________________,C瓶内气体的成分是_________。
(3)在步骤③中,先加热铁触媒的原因是____________________________________。反应管E中发生反应的化学方程式是___________________________。
制取氨气并完成喷泉实验(图中夹持装置均已略去)。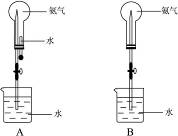
(1)写出实验室制取氨气的化学方程式:_________________________________________。
(2)收集氨气应使用___________法,要得到干燥的氨气可选用_____________作干燥剂。
(3)用图A装置进行喷泉实验,上部烧瓶已装满氨气,引发水上喷的操作是___________。该实验的原理是___________________。
(4)如果只提供如图B的装置,请说明引发喷泉的方法:___________________________。
实验室里若用下图装置制取氨气,请指出图中存在的问题,并简要说明如何改正。
存在问题:
改正方法: