根据硫化氢气体的实验室制法和性质完成下列填空。
根据硫化氢气体的实验室制法和性质完成下列填空。

1. 若用启普发生器制取硫化氢气体,则制取气体的原料可选用。
若用启普发生器制取硫化氢气体,则制取气体的原料可选用。
 a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁
a.稀硫酸与硫化亚铁 b.稀硝酸与硫化亚铁
 c.稀硫酸与硫化钠 d.稀盐酸与硫化亚铁
c.稀硫酸与硫化钠 d.稀盐酸与硫化亚铁
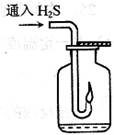
 2.现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器;(填编号)。
2.现要组装一套可以控制硫化氢气体产生速率的装置,请在下图中选择合适的仪器;(填编号)。

 3.如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液,
3.如右图,在一个充满氧气的集气瓶中加入少量品红稀硫溶液, 点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察
点燃硫化氢气体。在火焰自动熄灭后,停止通入气体,瓶内可观察 的现象是。
的现象是。
 4.在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为:
4.在上述集气瓶中继续通入硫化氢气体,振荡,发生反应的化学方程式为: 反应过程中,溶液的(填"变大"、"变小"或"不变")。
反应过程中,溶液的(填"变大"、"变小"或"不变")。
 5.点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是_。
5.点燃不纯的硫化氢气体可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是_。


 6.已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是_。
6.已知硫化氢气体在空气中的体积分数为4.3%~45.5%时会发生爆炸。当硫化氢气体在空气中的体积分数为30%时,其爆炸产物是_。
I.硝酸铜在1000℃时分解:Cu(NO3)2 Cu+2NO2↑+O2↑,用试管收集一试管气体并倒立于盛水的水槽中,写出气体溶解的化学反应方程式 ,并判断液体 (填“能”“不能”)充满整个试管(假定倒吸进试管的液体不流出)。
Cu+2NO2↑+O2↑,用试管收集一试管气体并倒立于盛水的水槽中,写出气体溶解的化学反应方程式 ,并判断液体 (填“能”“不能”)充满整个试管(假定倒吸进试管的液体不流出)。
II.工业上生产硝酸铜晶体的流程图如下:
①在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围.
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
②蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是 (结合离子方程式说明)。
③如图所示为硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),从图中获取如下信息,不正确的有 (填字母)。
a.C点溶液为Cu(NO3)2的不饱和溶液
b.30℃时结晶可析出两种晶体
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.将A点溶液升温至30℃时,可以析出Cu(NO3)2·3H2O晶体
④某些共价化合物(如H2O、NH3、N2O4等)在液态时发生了微弱的电离,如:2H2O OH—+H3O+,则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,则同时生成的另一种物质为 。
OH—+H3O+,则液态NH3电离的方程式是 ,液态N2O4电离得到电子数相差18的阴阳离子,因此可用Cu与液态N2O4反应制备无水硝酸铜,则同时生成的另一种物质为 。
一溴乙烷为无色液体,熔点-119.1℃,沸点38.4℃,常用于汽油的乙基化、冷冻剂和麻醉剂。制备一溴乙烷的反应原理为:NaBr+H2SO4=HBr↑+NaHSO4,CH3CH2OH+HBr→CH3CH2Br+H2O。实验室可用如下装置制备一溴乙烷: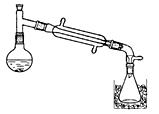
某学生的实验过程和具体操作可简述如下:
查阅资料可知:
①可能产生的副产物有: CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2,其中1,2-二溴乙烷为无色液体,熔点9.3℃,沸点131.4℃。
②油层a用浓硫酸处理可以除掉乙醚、乙醇和水等杂质。
请结合以上信息回答下列问题:
(1)实验过程中锥形瓶置于冰水混合物中的目的是 。
(2)水层a中的离子除Na+、H+、OH-和Br-外,还一定含有 ,检验该离子的方法是 。
(3)油层a、b均呈微黄色。该学生猜测油层b除一溴乙烷外还可能含有其它一种或多种副产物,为验证其成分设计了如下的实验操作。
| 实验步骤 |
预期现象和结论 |
| 步骤1:将油层b转移至 中,再加入足量稀 Na2SO3溶液充分振荡,静置。 |
|
| 步骤2:取步骤1的水层少量于试管中,加入稀硫酸酸化,再加入适量新制氯水及少量CCl4,充分振荡,静置。 |
溶液分层,下层呈橙红色,证明 。 |
| 步骤3:将步骤1的油层充分洗涤、干燥后装入蒸馏装置中, 至温度计升高至450C左右。 |
馏出蒸汽的温度稳定在38℃左右,不再有蒸汽馏出时,将蒸馏烧瓶中残留液体置于冰水浴中冷却,凝结成白色固体,则证明油层b中含有1,2-二溴乙烷。 |
(4)该同学在实验过程中加入了10mL乙醇(0.17mol),足量浓硫酸,适量水,以及0.15mol溴化钠,最后蒸馏获得了10.9g一溴乙烷产品。请计算产率 (用小数表示,保留二位小数)。
(16分)用芒硝(Na2SO4·10H2O)制备纯碱、铵明矾[NH4Al(SO4)2·12H2O]的生产工艺流程图如下所示: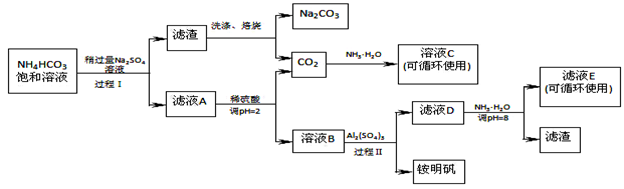
(1)溶液C中的溶质主要是 。
(2)铵明矾的溶液呈 性,铵明矾可用于净水,用离子方程式说明原理 。
(3)过程Ⅰ反应温度不能超过40℃,主要原因是 。
(4)运用化学平衡原理解释Na2SO4溶液稍过量的原因 。
(5)滤液E中溶质离子为 。
(6)写出工艺流程中焙烧的反应方程式 。
实验室可以用MgCl2•6H2O为原料制备碳酸镁晶须,主要流程如下: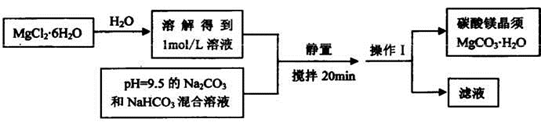
试回答:
(1)操作1的名称是 。
(2)上述反应过程要控制好温度,因为MgCO3置于水中长时间加热煮沸可完全生成 Mg(OH)2,其原因是 。
(3)另査阅文献,在加热煮沸时也可能生成碱式碳酸镁Mg5(OH)2(CO3)4·4H2O,写出该反应的化学方程式 。
(4)某课题组为了确定MgCO3在水中长时间加热煮沸后所得的固体成分,进行如下 研究。(注:Mg(OH)2,Mg5(OH)2(CO3)4.4H2O在煮沸时均不会分解)
①定性研究:请你完成下表中内容。
| 实验步骤 |
预期的实验现象和结论 |
| 取一定质量的固体样品 |
若 则固体产物为Mg(OH)2 |
②另取一定质量的固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?_______(填“能”或“否”),理由是
废旧物的回收利用既有利于节约资源,又有利于保护环境。某研究小组同学以废旧锌锰干电池为原料,将废旧电池含锌部分转化成ZnSO4·7H2O,含锰部分转化成纯度较高的MnO2,将NH4Cl溶液应用于化肥生产中,实验流程如下: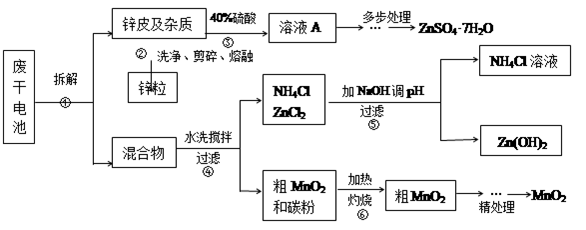
(1)操作②中所用的加热仪器应选 (选填“蒸发皿”或“坩埚”)。
(2)将溶液A处理的第一步是加入氨水调节pH为9,使其中的Fe3+和Zn2+沉淀,请写出氨水和Fe3+反应的离子方程式 。
(3)操作⑤是为了除去溶液中的Zn2+。已知25℃时,
| NH3·H2O的Kb |
Zn2+完全沉淀的pH |
Zn(OH)2溶于碱的pH |
| 1.8×10-5 |
8.9 |
>11 |
由上表数据分析应调节溶液pH最好为 (填序号)。
a.9 b.10 c.11
(4)MnO2精处理的主要步骤:
步骤1:用3%H2O2和6.0mol/L的H2SO4的混和液将粗MnO2溶解,加热除去过量H2O2,得MnSO4溶液(含少量Fe3+)。反应生成MnSO4的离子方程式为 ;
步骤2:冷却至室温,滴加10%氨水调节pH为6,使Fe3+沉淀完全,再加活性炭搅拌,抽滤。加活性炭的作用是 ;
步骤3:向滤液中滴加0.5mol/L的Na2CO3溶液,调节pH至7,滤出沉淀、洗涤、干燥,灼烧至黑褐色,生成MnO2。灼烧过程中反应的化学方程式为 。
(5)查文献可知,粗MnO2的溶解还可以用盐酸或者硝酸浸泡,然后制取MnCO3固体。
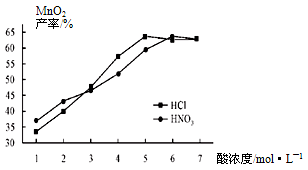
①在盐酸和硝酸溶液的浓度均为5mol/L、体积相等和最佳浸泡时间下,浸泡温度对MnCO3产率的影响如图,由图看出两种酸的最佳浸泡温度都在 ℃左右;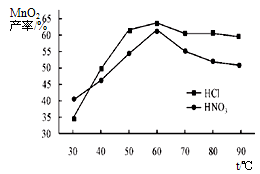
②在最佳温度、最佳浸泡时间和体积相等下,酸的浓度对MnCO3产率的影响如下图,由图看出硝酸的最佳浓度应选择 mol/L左右。