一溴乙烷为无色液体,熔点-119.1℃,沸点38.4℃,常用于汽油的乙基化、冷冻剂和麻醉剂。制备一溴乙烷的反应原理为:NaBr+H2SO4=HBr↑+NaHSO4,CH3CH2OH+HBr→CH3CH2Br+H2O。实验室可用如下装置制备一溴乙烷:
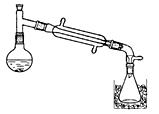
某学生的实验过程和具体操作可简述如下:

查阅资料可知:
①可能产生的副产物有: CH3CH2OCH2CH3、CH2BrCH2Br、CH2=CH2、Br2、SO2,其中1,2-二溴乙烷为无色液体,熔点9.3℃,沸点131.4℃。
②油层a用浓硫酸处理可以除掉乙醚、乙醇和水等杂质。
请结合以上信息回答下列问题:
(1)实验过程中锥形瓶置于冰水混合物中的目的是 。
(2)水层a中的离子除Na+、H+、OH-和Br-外,还一定含有 ,检验该离子的方法是 。
(3)油层a、b均呈微黄色。该学生猜测油层b除一溴乙烷外还可能含有其它一种或多种副产物,为验证其成分设计了如下的实验操作。
| 实验步骤 |
预期现象和结论 |
| 步骤1:将油层b转移至 中,再加入足量稀 Na2SO3溶液充分振荡,静置。 |
|
| 步骤2:取步骤1的水层少量于试管中,加入稀硫酸酸化,再加入适量新制氯水及少量CCl4,充分振荡,静置。 |
溶液分层,下层呈橙红色,证明 。 |
| 步骤3:将步骤1的油层充分洗涤、干燥后装入蒸馏装置中, 至温度计升高至450C左右。 |
馏出蒸汽的温度稳定在38℃左右,不再有蒸汽馏出时,将蒸馏烧瓶中残留液体置于冰水浴中冷却,凝结成白色固体,则证明油层b中含有1,2-二溴乙烷。 |
(4)该同学在实验过程中加入了10mL乙醇(0.17mol),足量浓硫酸,适量水,以及0.15mol溴化钠,最后蒸馏获得了10.9g一溴乙烷产品。请计算产率 (用小数表示,保留二位小数)。
【2015安徽理综化学】C、N、O、Al、Si、Cu是常见的六种元素。
(1)Si位于元素周期表第____周期第_____族。
(2)N的基态原子核外电子排布式为_____;Cu的基态原子最外层有___个电子。
(3)用“>”或“<”填空:
| 原子半径 |
电负性 |
熔点 |
沸点 |
| Al_____Si |
N____O |
金刚石_____晶体硅 |
CH4____SiH4 |
(4)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
0-t1时,原电池的负极是Al片,此时,正极的电极反应式是_____,溶液中的H+向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。
【2015海南化学】银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)下图所示原电池正极的反应式为 。
【2015北京理综化学】为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I- 2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
2Fe2++I2”反应中Fe3+和Fe2+的相互转化。实验如下:
(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到 。
(2)iii是ii的对比试验,目的是排除有ii中 造成的影响。
(3)i和ii的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。用化学平衡移动原理解释原因: 。
(4)根据氧化还原反应的规律,该同学推测i中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致I-的还原性弱于Fe2+,用下图装置(a、b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作 极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol/L AgNO3溶液,产生的现象证实了其推测,该现象是 。
(5)按照(4)的原理,该同学用上图装置进行实验,证实了ii中Fe2+向Fe3+转化的原因,
①转化原因是 。
②与(4)实验对比,不同的操作是 。
(6)实验I中,还原性:I->Fe2+;而实验II中,还原性:Fe2+>I-,将(3)和(4)、(5)作对比,得出的结论是 。
【2015北京理综化学】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式: 。
(2)在海洋循环中,通过下图所示的途径固碳。
①写出钙化作用的离子方程式: 。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整: + ===(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的还说中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。
②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度= mol/L。
(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
①结合方程式简述提取CO2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。
【2015上海化学】(本题共12分)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
(1)写出电解饱和食盐水的离子方程式 。
(2)离子交换膜的作用为: 、 。
(3)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式 。
(5)室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11