某同学取一定量淀粉进行水解实验,其实验步骤如下所示:
请回答下列问题:
① 所加入的试剂分别是
A______ __,B___ _____,C____ ____;
② 加B的原因是_____________________________________________________;
③由此可知淀粉是________(填“部分”、“完全”或“没有”)水解。
(13分)某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中发生反应的化学方程式:2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O
CaCl2 + 2NH3↑+ 2H2O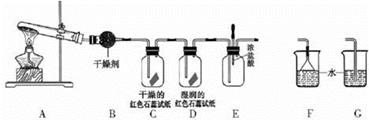
【实验探究】
(1)A中的反应 (填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取气体 (只填一种)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L(NH4C1的摩尔质量为 53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是 。
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是 (填“F”或“G”)。
【知识拓展】
(8)生石灰与水反应生成Ca(OH)2并放出热量[化学方程式为CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列 物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH固体
C.硫酸溶液 D.石灰石(含CaCO3)
【知识应用】
(9)2010年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500多居民深夜大转移。假如你在现场,你会采用什么自救为法? 。
氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。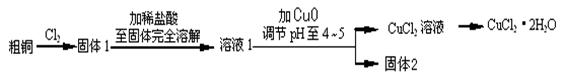
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。
① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”) 。
④装置Ⅳ中盛装的试剂是,其作用是。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) +4Cl-(aq)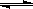 CuCl42-(aq) +4H2O(l)
CuCl42-(aq) +4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。
若增大氯离子浓度,K值(填“增大”、“减小”或“不变”) 。
②现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
a.b.。
用中和滴定法确定某烧碱样品的浓度,试根据实验回答下列问题:
(1)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用(填编号字母)作指示剂。
(A)甲基橙(B)石蕊(C)酚酞
(2)若选用甲基橙作指示剂,滴定终点的判断方法是
,此时溶液显性。
(3)根据下表数据,计算被测烧碱溶液的物质的量浓度是mol·L-1。]
| 滴定次数 |
待测溶液体积(mL) |
标准酸体积 |
|
| 滴定前的刻度(mL) |
滴定后的刻度(mL) |
||
| 第一次 |
10.00 |
0.40 |
20.50 |
| 第二次 |
10.00 |
4.10 |
24.00 |
| 第三次 |
10.00 |
0.40 |
21.50 |
(4)分析下列实验操作会对滴定结果产生的影响。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果。
③若烧碱溶液隔夜后滴定,选用甲基橙作指示剂时,则滴定结果。
由A、B、C、D四种金属按下表中装置进行实验。
| 装置 |
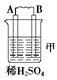 |
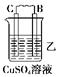 |
 |
| 现象 |
二价金属A不断溶解 |
C的质量增加 |
A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中电子流向是①_____________,溶液中H+向②____极移动.(用A、B填空)
装置甲中负极的电极反应式是③_____________________________________________。
(2)装置乙中B的金属性比C④_____,正极的电极反应式是⑤______________________。
(3)装置丙中A极的电极反应是⑥_______________,溶液的pH⑦________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是⑧_______________________________________。
(5).当丙中A极产生的气体在标准状况下为2.24L时,D极失去的电子的物质的量为⑨____________.若D为Zn,则D极质量减轻⑩_______g.
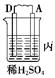
(13分)实验探究:探究碳、硅元素的非金属性的相对强弱,根据要求完成下列各小题
(1)实验装置: 
填写所示仪器名称AB
(2)实验步骤:
连接仪器、_____________、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是;
装置E中足量酸性KMnO4溶液的作用是;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填“能”或“否”),试管D中发生反应的离子方程式是。