(13分)某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中发生反应的化学方程式:2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O
CaCl2 + 2NH3↑+ 2H2O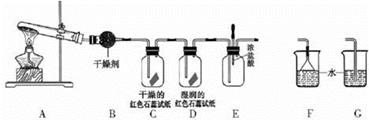
【实验探究】
(1)A中的反应 (填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取气体 (只填一种)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L(NH4C1的 摩尔质量为 53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是 。
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是 (填“F”或“G”)。
【知识拓展】
(8)生石灰与水反应生成Ca(OH)2并放出热量[化学方程式为CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列 物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH固体
C.硫酸溶液 D.石灰石(含CaCO3)
【知识应用】
(9)2010年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500多居民深夜大转移。假如你在现场,你会采用什么自救为法? 。
某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述B步骤操作的目的是 。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是 。
(1)下列各种情况,在其中Fe片腐蚀由快到慢的顺序是 .
(2)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度不大的环境中负极反应式为 ;正极反应式为 .
(本题共12分)下图是实验室制备1,2—二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。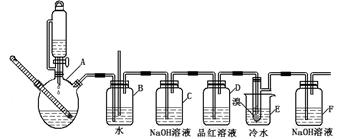
有关数据列表如下:
请完成下列填空:
41.A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:__________________。
42.气体发生装置使用连通滴液漏斗的原因_____________________________________。
43.请写出C装置中的离子反应方程式_______________________________________。
44.装置D中品红溶液的作用是__________________________________;
45.反应过程中应用冷水冷却装置E,其主要目的是___________________________;但又不能过度冷却(如用冰水),其原因是____________________________________。
46.学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是______________。
47.有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行______(填“是”或“否”),其原因是__________________________。
(13分)某小组对Cu与浓HNO3的反应进行研究。记录如下:
I.Cu与浓HN03反应的化学方程式是 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是 。
(2)乙认为溶液呈绿色是由溶解的NO2引起的。进行实验2:先将NO2通入B中,再鼓入N2。结果证实假设成立。则以上两步操作对应的现象分别是
、 。
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O =HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.NO—2能与Cu2+反应:Cu2+(蓝色)+4 NO2- Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2—4使溶液呈绿色。
丙进行如下实验: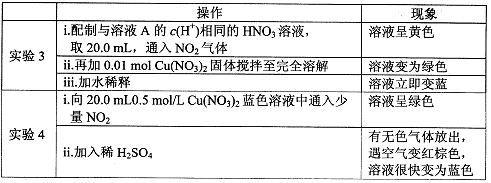
①亚硝酸分解的化学方程式是 。
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因 。
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是 ,请依据实验现象阐述理由: 。
某学生查阅资料得知溴乙烷的物理性质与制取方法如下表: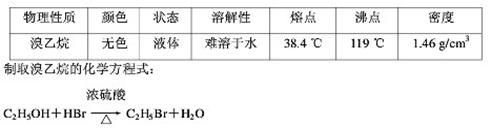
联想到所学溴苯的制取,他设计了制取溴苯和溴乙烷的装置I,主要实验步骤如下:
①检查气密性后,向烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓硫酸的混合液至恰好于进气导管口。
③将A装置中的纯铁丝向下插入混合液中。
④点燃B装置中酒精灯,用小火缓缓对锥形瓶加热10min.请填写下列空白:
(1)A中发生反应的方程式
(2)装置长导管a的作用是
(3)C装置中的U形管内用蒸馏水封住管底的作用是
(4)反应完毕后,U形管内的现象是 分离出溴乙烷时所用的最主要的仪器名称是 (只填一种)