某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述B步骤操作的目的是 。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是 。
下列实验现象预测正确的是
| A.实验I:打开止水夹,烧瓶内出现红色喷泉 |
| B.实验II:酸性KMnO4溶液中出现气泡,颜色无明显变化 |
| C.实验III:静置一段时间,小试管内有晶体析出 |
| D.实验IV:烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊 |
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。某化学兴趣小组同学对氯气的性质进行如下探究:
(1)兴趣小组同学按下图装置进行实验,探究Cl2的漂白性。
①通入Cl2 后,观察到的现象是 根据现象可得出的结论是 。
②集气瓶B发生反应的离子方程式是 。
③C装置的作用是 ,若有2.24L(标准状况下)Cl2被NaOH溶液完全吸收,则反应过程中转移的电子为 _mol。
(2)兴趣小组同学按下图装置进行实验,探究Cl2的氧化性。
①实验开始后,观察装置A 中的现象是 。
②装置C中发生反应的离子方程式是 。
③停止通入氯气,取装置B中少量溶液于洁净的试管中,向其中滴加足量稀盐酸,再向其中滴加氯化钡溶液,有白色沉淀生成。则通入Cl2时装置B中发生 反应的离子方程式是 。
(12 分)某工业残渣主要成分为 Fe2O3(含有少量 FeO、Cu、Mg 等杂质)某课外兴趣小组利用该残渣制取Fe2O3粉末的实验流程如下:(说明:流程中向黄色溶液中加入MgO的目的是调节溶液的酸碱性,使Fe3+生成沉淀而Mg2+不沉淀)
请回答下列问题:
(1)加入足量稀盐酸后,发生化学反应的类型有 (填写代号)。
| A.置换反应 |
| B.化合反应 |
| C.分解反应 |
| D.复分解反应 |
E.氧化还原反应
(2)加入适量氯水的作用是 ;
(3)写出灼烧红褐色沉淀时发生反应的化学方程式 。实验室灼烧红褐色沉淀可选用的装置是 (填序号)。
(4)若向黄色溶液中加入过滤①后的滤渣发生反应的离子方程式为 。
(5)检验黄色溶液中 Fe3+是否完全沉淀的方法是:取过滤②后的少量滤液于试管中, (请补充完整实验操作、现象、结论)。
回答实验室配制0.1 mol/L的NaOH 溶液480 mL实验中的下列问题。
(1)需NaOH g。
(2)有以下仪器:①烧杯②100 mL量筒③1000 mL容量瓶④500 mL容量瓶⑤玻璃棒 ⑥托盘天平。
配制时,必须使用的仪器有 ,还缺少的仪器是 。
(3)下列称量NaOH 的操作中,正确的是 (填序号,下同)
①把NaOH直接放在托盘上称量 ②把NaOH放在纸上称量
③把NaOH放入烧杯中称量
(4)使用容量瓶前必须进行的一步操作是 。
(5)配制过程中,下列操作会引起浓度偏高的是 。
①未洗涤烧杯、玻璃棒
②NaOH溶液未冷却至室温就转移到容量瓶中
③容量瓶不干燥,含有少量蒸馏水
④称量NaOH的时间太长
⑤定容时俯视刻度
四氯化锡常用于染色的媒染剂等,工业上常用氯气与金属锡反应制备四氯化锡。已知SnCl4为无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟。实验室可用下列装置合成四氯化锡(夹持装置略)。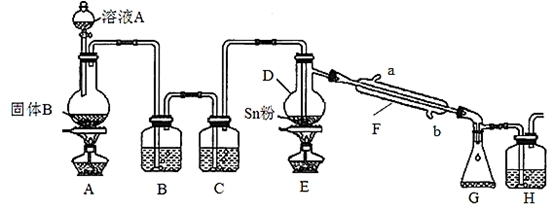
(1)装置D的名称为 ;
(2)冷凝水应从 (填“a”或“b”)口进入F中;
(3)装置A中固体B为黑色粉末,写出烧瓶中发生反应的化学反应方程式为 ;
(4)假设没有装置C,在D中除生成SnCl4外,可能得到的副产物为 ;
(5)装置E中加热的目的是 、 ;
(6)装置H中盛放足量的FeBr2溶液可吸收尾气中的氯气,其反应的离子反应方程式为 。
(7)该实验装置存在设计缺陷,你的改进措施为 。
(8)若装置A中标准状况下生成6.72L气体,假设不计气体损耗且Sn足量,反应完毕后在G 中锥形瓶里收集到37.20 g SnCl4,则SnCl4的产率为 (已知SnCl4相对分子质量为261)。