氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。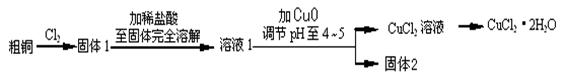
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。
① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③ 有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”) 。
④装置Ⅳ中盛装的试剂是 ,其作用是 。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) +4Cl-(aq)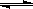 CuCl42-(aq) +4H2O(l)
CuCl42-(aq) +4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。
若增大氯离子浓度,K值(填“增大”、“减小”或“不变”) 。
②现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
a. b. 。
摄影胶卷上涂的感光材料主要是AgBr。在照相时按动快门的一瞬间,进入相机的光使AgBr发生了分解反应 。由于进光量极少,分解出的Ag极少,所以必须通过化学方法进行显影才能看到底片上的影像。对苯二酚是一种常用的显影剂,在显影时发生了如下变化:
。由于进光量极少,分解出的Ag极少,所以必须通过化学方法进行显影才能看到底片上的影像。对苯二酚是一种常用的显影剂,在显影时发生了如下变化:
(1)曝光时所产生的微量Ag在显影过程中________。
A.是氧化剂 B.是还原剂
C.起催化剂的作用 D.不起什么作用
(2)显影液中如果只溶有对苯二酚,显影速度则非常缓慢。为提高显影速度,可加入_________。
A.Na2SO4B.Na2SO3C.Na2CO3D.Na2S2O3
(3)溶于显影液中的氧气能与对苯二酚反应,最终生成棕褐色的污斑,影响底片的质量。
为避免形成污斑,可向显影液中加入__________。
A.Na2SO4B.Na2SO3C.Na2CO3D.Na2S2O3
设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱顺序是:CH3COOH>H2CO3>C6H5OH。
(1)利用上图所示的仪器可以组装实验装置,则仪器连接顺序为:________接________,________接________,________接________。
(2)有关反应的方程式为:________________________________________________________。
根据如图所示实验装置图,完成以下问题:
(1)这套装置可实现______________________等实验目的。
(2)仪器连接安装好进行实验前如何检查装置的气密性?答:____________________________
________________________________________________________________________________
_______________________________________________________________________________。
(3)实验时,点燃B处的酒精灯,先___________,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是_____________________,发生的主要反应的化学方程式为_____________________。当反应进行一段时间后,移去酒精灯,继续不断的缓缓鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个________反应。
(4)装置C的作用是_______________,能在此处观察到的现象是________________________。
(5)D装置产生的现象是__________,发生反应的化学方程式是_________________________。
(6)E装置的试管中所得溶液的成分可能有_____________________ (写化学式)。
某化学小组采用类似制乙酸乙酯的装置(如图Ⅰ)以环己醇制备环己烯。
已知:
| 密度(g·cm-3) |
熔点(℃)沸 |
点(℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
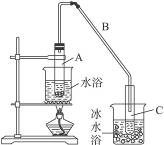
图Ⅰ
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_______________。
②试管C置于冰水浴中的目的是_________________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。中和饱和食盐水,振荡、静置、分层,环己烯在_______________层(填“上”或“下”),分液后用_______________(填入编号)洗涤。
a.KMnO4溶液
b.稀H2SO4
c.Na2CO3溶液
图Ⅱ
②再将环己烯按图Ⅱ装置蒸馏,冷却水从____________口进入。蒸馏时要加入生石灰,目的是____________。
③收集产品时,控制的温度应在____________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________________________。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是____________。
a.用高锰酸钾酸性溶液b.用金属钠c.测定沸点
乙醇的沸点是78 ℃,能与水以任意比例混溶。乙醚(CH3CH2OCH2CH3)的沸点为34.6 ℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理如下:
2CH3CH2OH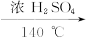 CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O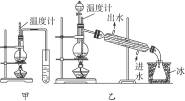
图6-3
(1)图6-3中甲和乙是两套实验室制乙醚的装置,选择装置__________最合适,理由是______________________________。
(2)反应液中应加入沸石,其作用是________________________________________。
(3)反应中温度计的位置应在____________________。
(4)用装置乙制得的乙醚中可能含有大量杂质,这种杂质是__________,除去这种杂质的简易方法是____________________。
(5)如果反应温度太高将会发生__________反应,产物是__________。