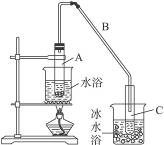
某化学小组采用类似制乙酸乙酯的装置(如图Ⅰ)以环己醇制备环己烯。
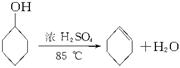
已知:
| |
密度(g·cm-3) |
熔点(℃)沸 |
点(℃) |
溶解性 |
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
图Ⅰ
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_______________。
②试管C置于冰水浴中的目的是_________________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。中和饱和食盐水,振荡、静置、分层,环己烯在_______________层(填“上”或“下”),分液后用_______________(填入编号)洗涤。
a.KMnO4溶液
b.稀H2SO4
c.Na2CO3溶液

图Ⅱ
②再将环己烯按图Ⅱ装置蒸馏,冷却水从____________口进入。蒸馏时要加入生石灰,目的是____________。
③收集产品时,控制的温度应在____________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是________________________。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是____________。
a.用高锰酸钾酸性溶液 b.用金属钠 c.测定沸点
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到主要含Cu、Al及少量Fc、Au、Pt等金属的混合物,设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
| 沉淀物 |
Fe( OH)2 |
Fe( OH)3 |
Al( OH)3 |
Cu( OH)2 |
| 开始沉淀 |
5.8 |
1.1 |
4.0 |
5.4 |
| 完全沉淀 |
8.8 |
3.2 |
5.2 |
6.7 |
请回答下列问题:
(1)第①步操作前需将金属混合物进行粉碎,其目的是;
(2)某学生认为用H2O2代替浓HNO3更好,理由是;
请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式是。
(3)第②步中应将溶液pH调至。
(4)由滤渣2制取Al2( SO4)3.18H2O,探究小组设计了两种方案:
你认为种方案为最佳方案,理由是、。
(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成l00mL溶液,取l0m溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.l000mol·L-1Na2S2O3标准溶液滴定至终点,共消耗14. 00mL Na2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2+ +4I-=2CuI(白色)↓+I2 2S2O +I2= 2I-+S4O
+I2= 2I-+S4O
①样品中硫酸铜晶体的质量分数为____。
②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是。
从含镁、钾盐湖水中蒸发最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O),它在空气中极易潮解、易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:①准确称取5. 550g样品溶于水,配成l00mL溶液。②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0. 580g。③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g。
(1)步骤②中检验白色固体已洗净的方法是。
(2)已知某温度下Mg( OH)2的Ksp ="6.4" xl0-12,当溶液中c(Mg2+)≤1.0×10 -5mol·L-1可视为沉淀完全,则应保持溶液中c(OH-)≥mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见表3:
| 乙醇 |
溴乙烷 |
溴 |
|
| 状态 |
无色 液体 |
无色 液体 |
深红棕色 液体 |
| 密度/g·cm-3 |
0.79 |
1.44 |
3.1 |
| 沸点/℃ |
78.5 |
38.4 |
59 |
表3.乙醇、溴乙烷、溴有关参数
(1)制备操作中,加入的浓硫酸必需进行稀释,其目的是(选填序号)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂
(2)写出溴化氢与浓硫酸加热时发生反应的化学方程式。
(3)图中试管C中的导管E的末端须在水面以下,其原因是。
(4)加热的目的是。
(5)为除去产品中的一种主要杂质,最好选择下列(选填序号)溶液来洗涤产品。
A.氢氧化钠 B.碘化亚铁 C.亚硫酸钠 D.碳酸氢钠
(6)第(5)步的实验所需要的玻璃仪器有。
硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O是一种浅绿色晶体,在水中的溶解度较小,不溶于乙醇。某实验小组利用镀锌铁片来制备硫酸亚铁铵的过程如下:
(1)加入盐酸是为了除去锌镀层,判断锌镀层已被除去的现象是。
(2)A物质可以是(选填序号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是。
(3)操作Ⅱ的名称为。
(4)采用晾干而不用加热烘干晶体的原因是。
(5)工业上常用K2Cr2O7溶液测定硫酸亚铁铵的纯度,反应中Cr2O72—被还原成Cr3+。
写出硫酸亚铁铵溶液与酸性K2Cr2O7溶液反应的离子方程式。
海水是应用前景广阔的化工原料资源,从海水中可提取各种化工原料.如图是工业上对海水的几项综合利用的示意图(已知气体X为电解饱和食盐水所得;母液苦卤中主要含有Ca2+、Mg2+,Cl-,SO42-、Br-等离子)请回答:
(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,梢制时所用的试剂为:
| A.盐酸 | B.氯化钡溶液 | C.氢氧化钠溶液 | D.碳酸钠溶液,则加入试剂的顺序是(填编号)______ |
(2)气体X的化学式为______,操作a所用的主要仪器是______。
(3)加入溶液Y的目的是______,用CaO调节溶液Z的pH,可以除去Mg2+得到溶液W。由表中数据可知,理论上可选择pH最大范围是______。酸化溶液W时,使用的试剂为______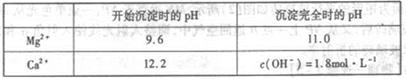
(4)将气体X依次通过下列装置以验证气体X的性质:
①通入气体X后,A中出现的现象是____________
②C装置中发生反应的离子方程式为____________。
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤)
________________________________________________________________________