在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如图418。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
图4-18
(1)阳极上的电极反应式为_______________________。
(2)阴极上的电极反应式为_______________________。
(3)原上层液体是______________________。
(4)原下层液体是______________________。
(5)搅拌后两层液体颜色发生变化的原因是_______________________。
(6)要检验上层液体中含有的金属离子,其方法是_______________,现象是_______________。
某化学兴趣小组的同学设计了一套实验方案探究元素周期表中元素性质的变化规律;同一周期内从左到右元素金属性的递变规律;同一主族内从上到下元素非金属的递变规律。
| 实验方法(Ⅰ) |
实验现象(Ⅱ) |
| 1、钠与冷水反应 |
a、溶液变红色 |
| 2、向NaOH溶液中滴加酚酞 |
b、产生白烟 |
| 3、向新制H2S饱和溶液滴加新制的氯水 |
c、反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色。与酸反应剧烈,产生大量气泡且可以燃烧 |
| 4、镁带在空气中燃烧 |
d、产生大量气泡、气体可以燃烧 |
| 5、NaI溶液中加入溴水和CCl4 |
e、下层溶液变橙色 |
| 6、镁带与沸水反应,再向反应后溶液中滴加酚酞。镁与2mol/L盐酸反应。 |
f、浮于水面,熔成小球,迅速向四处游动 |
| 7、蘸浓氨水与浓盐酸的两玻璃棒接近 |
g、下层溶液变紫色 |
| 8、NaBr溶液中加入氯水和CCl4 |
h、发出耀眼的强光,生成白色物质 |
| 9、铝片与2mnol/L盐酸反应 |
i、生成淡黄色沉淀 |
回答下列问题
(1)从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的答案在空格中(有几个填几个,不一定把空格填满)。
| 1、探究同一周期从左到右元素金属性的递变规律 |
2、探究同一主族内从上到下元素非金属性的递变规律 |
|||||||
| Ⅰ |
||||||||
| Ⅱ |
(2)实验结论(表示元素具体的强弱顺序):
金属性:____________________非金属性:
(3)上表(Ⅰ)中实验方法9反应的离子方程式
(4)上表(Ⅱ)中实验现象e反应的离子方程式
如图所示的仪器装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯。反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验乙酸乙酯和水层:第一种方法加入几滴KMnO4溶液,结果两层都没有颜色,无法区别;第二种方法是加入少量碘片,结果是上层液体呈紫红色。
在这个实验中:(1)水浴的作用是,浓硫酸的作用是。
(2)水流经冷凝管时,应从口进入。(填a或b)
(3)烧杯中乙酸乙酯在层,根据是,加入几滴KMnO4溶液后,水层不显紫色,是因为。
(4)粗制乙酸乙酯经过提纯,可得到纯净的酯,提纯的操作方法是。
(1)某学生用实验室常见的酸、碱、盐和金属为反应物,并利用一个底部有小孔的试管和一个广口瓶组装成如图所示的替代简易气体发生器的即开即停装置,该装置中装有铜丝网隔板,利用该装置可制取哪些气体_________________(答2种即可);
若将铜丝网隔板改为铁丝网隔板,则该装置可用于制取何种气体________,写出反应的离子方程式_______________。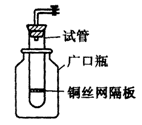
(2)①写出CO2和Na2O2反应的化学方程式______________________。
②某学生判断SO2和Na2O2反应能生成硫酸钠,你认为他的判断是否合理_______,(填“是或否”)简要说明理由:______________________。
③该同学无法断定SO2和Na2O2反应中是否有氧气生成,拟使用下列装置进行实验。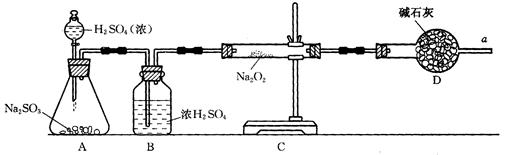
装置中B的作用是_______________,D的作用是_______________。
④为确认SO2和Na2O2反应产物,该同学设计了以下实验步骤,你认为应进行的操作按顺序排列是(填序号)________。
| A.用带火星的细木条靠近干燥管口a,观察细木条是否着火燃烧. |
| B.将C装置中反应后的固体物质溶于适量水配成溶液. |
| C.在配成的溶液中加入用硝酸酸化的硝酸钡溶液,观察是否有沉淀生成. |
| D.在配成的溶液中先加入盐酸,再加入氯化钡溶液,观察是否有气泡或沉淀生成 |
控制变量法是研究化学变化量的重要思想方法。请仔细观察下表中50mL稀盐酸和1g碳酸钙反应的实验数据:
| 实验 序号 |
碳酸钙 状态 |
C(HCl)/ mol·l-1 |
溶液温度/℃ |
碳酸钙消失 时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
块状 |
0.5 |
20 |
39 |
400 |
| 2 |
粉末 |
0.5 |
20 |
40 |
60 |
| 3 |
块状 |
0.6 |
20 |
41 |
280 |
| 4 |
粉末 |
0.8 |
20 |
40 |
30 |
| 5 |
块状 |
1.0 |
20 |
40 |
120 |
| 6 |
块状 |
1.0 |
30 |
50 |
40 |
(1)该反应属于反应(填“吸热”或“放热”)。
(2)实验5、6表明对反应速率的影响,说明,反应速率越快。
(3)根据实验1、3、5可以得出条件对反应速率的影响规律是。
(4)从本实验数据中分析,影响化学反应速率的因素还有,能表明这一规律的实验序号是。
为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2),并将Cl2依次通入NaBr溶液和KI-淀粉溶液中。如图所示仪器及药品,试回答: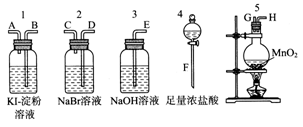
(1)若所制取气体从左向右流向时,上述仪器接口的连接顺序为________接________、________接________、________接________、________接________。(填字母)
(2)实验开始后装置5中反应的离子方程式为______________________________。
(3)装置3的作用是__________________________________,反应的离子方程式为_______________________________。
(4)装置1中产生的现象是:溶液先变蓝一段时间后蓝色褪去,生成两种强酸,请写出蓝色褪去的化学方程式:___________________________________________________。