已知

若使46液态乙醇完全燃烧,最后恢复至室温,则放出的热量为( )
A.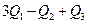 |
B. |
C.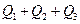 |
D.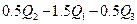 [:] [:] |
某小组为研究电化学原理,设计如图装置。下列叙述错误的是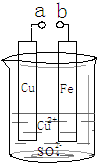
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动 |
| D.无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色 |
下列表述中,合理的是
| A.将水加热,Kw增大,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
下图为一原电池的结构示意图,下列说法中,错误的是 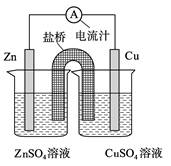
| A.Cu电极为正电极 |
| B.原电池工作时,电子从Zn电极流出 |
| C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu |
| D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液 |
一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是
| A.加入少量稀NaOH溶液 | B.加入少量CH3COONa固体 |
| C.加入少量NH4HSO4固体 | D.加入少量Na2CO3浓溶液 |
对于反应A(g)+3B(g) 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.2mol/(L•s)B.v(B)="0.2" mol/(L•s)
C.v(B)=0.3mol/(L•s)D.v(C)=0.2mol/(L•s)