(每小题3分,共9分)恒温恒压下,在一个容积可变的密闭容器中发生如下反应:
(1)若开始时通入 ,达平衡时生成
,达平衡时生成 的转化率为 。
的转化率为 。
(2)若开始时通入 ,达平衡时SO2的物质的量为 mol。
,达平衡时SO2的物质的量为 mol。
(3)若在(2)的平衡混合物中再通入bmol SO3,则达到平衡时SO3的体积分数是 。
(1)在中学所学的金属单质中,在冷的浓硫酸或硝酸中会发生钝化现象的有_______(填化学式);
(2)写出铁与浓硫酸(足量)在加热条件下反应的化学方程式___________________;
(3)铝分别与氢氧化钠溶液和稀硫酸反应,若在相同情况下得到相同体积的气体,则两个反应中消耗氢氧化钠与硫酸的物质的量之比为___________。
一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g) + 2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)若升高温度,甲醇的生成率减小,则该反应的正反应为__________反应(放热或吸热);
(2)改变下列条件,不能加快化学反应速率的是__________;
a.移走甲醇 b.增大压强
c.扩大容器体积 d.升高温度
(3)写出两个既能加快反应速率,又能使一氧化碳的转化率提高的措施:_______________;______________________________________。
已知反应:Ⅰ 2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
Ⅱ Fe2(SO4)3 + 2HI → 2FeSO4 + I2 + H2SO4
Ⅲ K2Cr2O7 + 6FeSO4 +7 H2SO4 →3 Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
(1)上述三个反应中,属于非氧化还原反应的是(填序号)
(2)Fe2(SO4)3、K2Cr2O7、I2的氧化性由强到弱的顺序为;
(3)反应Ⅱ中的还原产物是;
(4)在下式中标出电子转移的方向和数目:
K2Cr2O7 + 6FeSO4 + 7H2SO4 →
(5)若用K2Cr2O7与HI反应,每生成12.7g I2生成,转移电子个。
下表标出的是元素周期表短周期的部分元素。根据下表回答下列问题(用元素符号或相应的化学用语填写)(注:以下问题回答范围均限于A~H的元素)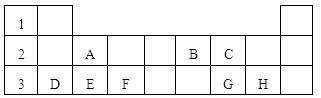
(1)B元素的单质在空气中体积含量最大,则其气态氢化物的电子式为___________;
(2)八种元素中原子半径最大的是____________(选填编号);
各电子层上的电子数相同的元素是____________(填相应元素的符号);
(3)G、H两种元素的非金属性强弱可以通过比较这两种元素__________(选填编号);
a.原子的得电子的能力 b.含氧酸的酸性
c.气态氢化物的稳定性 d.单质的熔沸点
(4)F元素的最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式是________________。
(5)如图,将潮湿的由H元素构成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是___________________。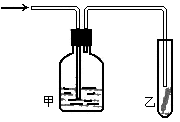
a.浓硫酸 b.NaOH溶液
c.KI溶液 d.饱和食盐水
碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。且B的核磁共振氢谱显示有3组不同的峰。
(1)A的分子式是。
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是(填序号)。
A.C5H12O3B.C4H10C.C6H10O4 D.C5H10O
(3)①B的结构简式是。
②A不能发生的反应是(填序号)。
A.取代反应 B.消去反应 C.酯化反应 D.还原反应
(4)与A互为同分异构体的羧酸有种。
(5)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,该异构体的结构简式是:。