以下各种溶液不用任何外加试剂,就能实现鉴别的是____________________
(1)Al(NO3)3 FeCl3 NaOH FeSO4 NaHCO3
(2)Na2CO3 BaCl2 AgNO3 Na2SO4 NH3·H2O
(3)KOH NaCl NaHCO3 MgSO4 KNO3
(4)CuSO4 KHSO4 NaHCO3 KOH
(5)NaAlO2 Na2SiO3 Na2CO3 NaHSO4 NaCl
(6)NH4Cl Na2SO4 (NH4)2SO4 Ba(OH)2 AlCl3
硅、铝和铁及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)Al的原子结构示意图为 ;Al与NaOH溶液反应的离子方程式为
。
(2)30Si原子的中子数为 ,Si的晶体类型为 。
(3)Al3+与Yn—的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是 。
(4)某焊药熔渣36.0g(含Fe2O3、Al2O3、SiO2)加入足量稀盐酸,分离得到11.0g固体,滤液中加入过量NaOH溶液,分离得到21.4g固体。则此熔渣中Al2O3的质量分数为
。
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答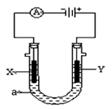
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为。在X极附近观察到的实验现象是。
②Y电极上的电极反应式为。检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是,电极反应为。
②Y电极的材料是,电极反应式为。
(说明:杂质发生的电极反应不必写出)
抗击“非典”期间,过氧乙酸(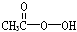 )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
①□MnO4+□H2O2+□H+═□Mn2++□O2十□H2O
② H2O2+2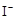 +2H+ ═I2+2H2O
+2H+ ═I2+2H2O
④ I2+2S2O32-═S4O62-+2I-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
□MnO-4+□H2O2+□H+ ═□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是_____________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·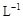 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol· 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中只有C为金属元素,A、C与B、D分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,这四种元素的单质中有2种气体,2种固体。
(1)写出元素符号:A,B,C,D。
(2)在由A、B、C、D四种元素两两组成的二元化合物中,非极性分子有;其结构中存在非极性键的分子晶体有;其结构中存在非极性键的离子晶体有__________;(各填一种物质的化学式)
(3)写出两种均含有A、B、C、D四种元素的化合物两种:、。
把淀粉溶液溶于沸水中,制成淀粉胶体。
(1)鉴别水溶液和胶体可以利用的方法是
。
(2)60℃左右时,在淀粉胶体中加入淀粉酶,充分反应。然后把反应后的全部液体装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。从半透膜袋里析出的物质是,该操作的名称是。