用铅蓄电池(总反应:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O)电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。
2PbSO4+2H2O)电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。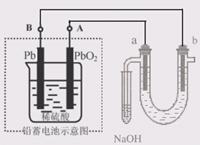
下列说法中正确的是 : ( )
| A.铅蓄电池放电时的正极反应是:PbO2+4H++SO42- =PbSO4+2H2O |
| B.电解苦卤水时,a 电极首先放电的是Br―而不是Cl―,说明当其它条件相同时Br―的还原性强于Cl― |
| C.铅蓄电池充电时,A极应与外接电源负极相连 |
| D.忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01 molH2SO4 |
下列现象或反应的原理解释正确的是
| 选项 |
现象或反应 |
原理解释 |
| A |
铝箔在酒精灯火焰上加热熔化但不滴落 |
铝导热性强,温度达不到着火点 |
| B |
合成氨反应需在高温条件下进行 |
该反应为吸热反应 |
| c |
向某溶液中加入盐酸酸化的氯化钡溶液, 有白色沉淀生成 |
该溶液中不一定含有S04一 |
| D |
铜与浓硝酸反应生成N02,而与稀硝酸 反应生成NO |
浓硝酸的氧化性弱于稀硝酸的氧化性 |
以石墨层间化合物氟化石墨为正极,锂为负极,用溶有LiCI04的有机溶剂作电解质新型锂电池,能使输出电压比普通电池提高2倍,该电池具有体积小、重量轻、贮藏性好等特性。电池总反应:nLi+(CF)。 nLiF+nC。则下列说法不正确的是
nLiF+nC。则下列说法不正确的是
A.放电过程中,Li+从负极区向正极区迁移
B.负极反应式:nLi-ne- nLi+
nLi+
C.正极反应式:(CF)n+nLi+ +ne- nC+nLiF
nC+nLiF
D.可以用水代替有机溶剂
下列叙述正确的是
A.10 mL O.1 mol·L-1NH4C1溶液与5 mL、0.2 mol·L-1NaOH溶液混合:
c(Na+)=c(C1-)>c(OH-)>c(NH4+)>c(H+)
B.0.1 mol.L-1 pH=4的NaHB的溶液中,c(Na+) >c(HB- ) c(H2 B)>c(B2-)
C.常温时,NaHC03溶液中:c(Na+)= c(HC03-) +c(H2 CO3)
D.相同条件下,pH=5的①NH4 C1溶液、②CH3 COOH溶液、③稀盐酸中由水电离出的c(H+):①>②>③
雌黄与浓硝酸反应如下:As2 S3+28HNO3(浓) 2H3As04 +3H2S04+28N02↑+8H2O,
2H3As04 +3H2S04+28N02↑+8H2O,
下列说法正确的是
| A.氧化产物只有H2S04 |
| B.1mol As2S3发生反应,有28 mol电子转移 |
| C.该反应中As2S3既是氧化剂又是还原剂 |
| D.As2S3不可能与氧气反应 |
下列离子方程式书写正确的是
A.将S02通入酸性KMnO4溶液:2MnO4-+5S02+2H20 2Mn2++5SO42-+4H+ 2Mn2++5SO42-+4H+ |
B.将Na2CO3溶液滴入等浓度等体积的盐酸中:C032-+H+ HCO3- HCO3- |
C.过氧化钠固体与水反应,2022-+2H20 40H- +02↑ 40H- +02↑ |
D.硫化钠水溶液呈碱性的原因:S2-+2H20 H2S+20H- H2S+20H- |