(11分)电化学在工业生产中有广泛应用。
(1)右图所示装置中,两玻璃管及烧杯中是滴有酚酞的NaCl饱和溶液,
C(I)、C(II)为多孔石墨电极。
①电解NaCl饱和溶液的化学方程式为 。
②接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。则电极C(I)是 (填“阳”或“阴”)极;检验C(II)电极反应所得气体产物的方法和现象是 。
③一段时间后(玻璃管中液面未脱离电极),断开S1,则C(I)、C(II)两玻璃管内气体的体积V(I)、V(II)的关系是:V(I) V(II)(填“>”、 “=”或 “<”) 。断开S1接通S2,电流表的指针发生偏转,此时电极C(II)是 (填“正”或“负”)极;C(I)的电极反应是: 。
(2)若用此装置精炼粗铜,断开S2,接通S1,电解液选用CuSO4溶液,当电路中有0.04 mol电子通过时,阴极增重 g。
A、B、C、D、E为元素周期表中短周期元素形成的五种离子,A、B、C、D四种离子的电子数均比E的电子数少8。
(1)A与B结合成的化合物甲中既有离子键又有共价键,A与C结合成的化合物乙难溶于水,乙溶于甲的水溶液得无色透明溶液,C元素在周期表中的位置为 _,乙与甲的水溶液反应的离子方程式为__________________________________.
(2)B与E结合成化合物丙,其中离子数之比为2∶1,A与D结合成化合物丁,丁与丙反应产生无色无味的气体,则丙的电子式为: _,1molD的粒子中有 _mol质子
(3)有一种液态氮氢化合物戊,戊分子与E的电子数相同,是“神舟七号”飞船发射时使用的高能燃料之一,结构分析发现该分子结构中只有单键,与氨相似,则戊的结构式为 ___。
A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
| 阳离子 |
Na+、Al3+、Ba2+、NH4+ |
| 阴离子 |
Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下①B溶液分别与C、D混合,均有白色沉淀生成②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体
回答下列问题:
(1)A所含的阳离子和C所含阳离子的半径大小____>______(填离子符号)。B所含的阴离子是________
(2)C溶液呈___性(填“酸性”或“碱性”),其原因是__________________
(用离子方程式解释)。D的化学式是____________
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,
溶液的pH为_______(设电解过程溶液体积不变),阳极的电极反应式为 _____
(4)若将④阳极产生的气体通入A溶液中至恰好完全反应时,则溶液中各离子
浓度由大到小的排列顺序为__________________________
工业上利用氨催化氧化后,经过一系列反应可以制备硝酸。
(1)氨气催化氧化的化学方程式为 _
(2)某工厂排出的尾气中NOx的含量为0.56%(体积分数),用氨气可以将其转化为无害气体,发生的反应为:6NOx+4xNH3=(3+2x)N2+6xH2O若处理1× L(标准状况)该尾气需42.5gNH3,则x= _。
L(标准状况)该尾气需42.5gNH3,则x= _。
(3)NO和CO都是汽车尾气中的有害物质,必须进行处理。为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。写出净化过程中的总化学反应方程式:。
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3 g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,发现开始溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24 L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是: 和 。
(2)试通过计算确定该结晶水合物的化学式为 。
(3)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0 mol·L-1。
①加入Ba(OH)2溶液后,若所得沉淀的总物质的量最大,则反应的离子方程式为 。
②若加入75 mL的Ba(OH)2溶液,则得到的沉淀质量为 g。
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。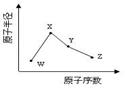
(1)X位于元素周期表中的位置;18W与X形成原子个数1:1的物质,该物质与H2O反应的化学方程式。(在化学式中标出质量数18)
(2)X的单质和Y的单质相比,熔点较高的是_____(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是_______(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是________。