(9分)下列各图中的纵坐标表示沉淀的物质的量,横坐标表示加入x的物质的量,请将各图一一对应的反应的代号填入每图下方的括号内。
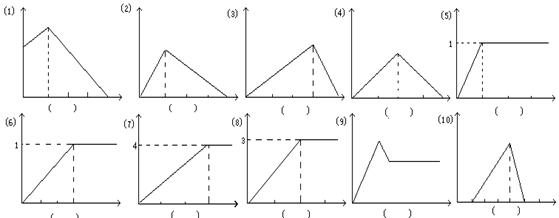


| A.Ca3(PO4)2悬浊液中滴入H3PO4 | B.NaAlO2溶液中通入HCl |
| C.Ba(OH)2溶液中通入SO2 | D.石灰水中通入CO2 |
E.AlCl3溶液中滴入氨水 F.AlCl3溶液中滴入NaAlO2溶液
G.SO2溶液中通入H2S气体 H.稀硫酸中滴入Ba(OH)2溶液
I.AlCl3、MgSO4的混合溶液中加入过量NaOH溶液 J.在盐酸酸化的AlCl3溶液中,滴入KOH溶液 K.AlCl3溶液中滴入NaOH溶液
J.在盐酸酸化的AlCl3溶液中,滴入KOH溶液 K.AlCl3溶液中滴入NaOH溶液
取等物质量浓度的NaOH溶液两份,每份为50ml。向其中通入一定量的CO2,随后分别取溶液10ml,将其稀释成100ml,并分别向稀释后的溶液中逐滴加入0.1mol/L的HCI溶液,产CO2的体积(标准状况)与加入盐酸体积之间的关系如图所示(设分别为A、B两种情况)。
 回答下列问题:
回答下列问题: (1)在(A)情况下,溶质为(写化学式),其物质的量之比为,在标准状况下,通人CO2气体的体积为 。
(1)在(A)情况下,溶质为(写化学式),其物质的量之比为,在标准状况下,通人CO2气体的体积为 。 (2)在(B)情况下,溶质为(写化学式),其物质的量之比为,在标准状况下,通人CO2气体的体积为 。
(2)在(B)情况下,溶质为(写化学式),其物质的量之比为,在标准状况下,通人CO2气体的体积为 。 (3)原NaOH溶液的物质的量浓度为 。
(3)原NaOH溶液的物质的量浓度为 。
一定量的氢气在氯气中燃烧,所得混合物用100
3.00
溶液(密度为1.12
)恰好完全吸收,测得溶液中含有
的物质的量为0.0500
。
(1)原
溶液的质量分数为。
(2)所得溶液中
的物质的量为
。
(3)所用氯气和参加反应的氢气的物质的量之比
=。
1体积SO2和3体积空气混合后,在450℃以上通过V2O5催化剂发生如下反应:2SO2(气)+O2(气) 2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。
2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
;
、
、
、
四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了、性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
(1)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
反应中___________ 元素被还原。
(2)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)类似,化学上称为拟卤素。[如:(SCN)2+H2O HSCN+HSCNO],它们阴离子的还原性强弱为:Cl-<Br-<SCN-<I-。试写出以下反应方程式:
HSCN+HSCNO],它们阴离子的还原性强弱为:Cl-<Br-<SCN-<I-。试写出以下反应方程式:
①(CN)2与KOH溶液反应的化学方程式;
②NaBr与KSCN的混合物中加入(CN)2的离子方程式。