A、B、C是常见短周期元素的单质,常温下D为无色液体 ,E是一种常见的
,E是一种常见的
温室气体。其转化关系如图所示(反应条件和部分产物略去)。试回答: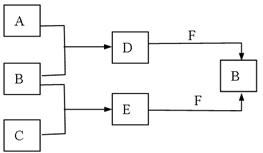
(1)F的电子式为 ;
(2)少量的金属单质铝与D和F混合,写出反应的离子方程式 。
(3)D2mol、E 2mol与3molF在密闭容器中充分反应,所得固体成分为 ;其相应的物质的量为 。
化学的魅力之一来自于许许多多的“最”。例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇……。根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式,该分子属
于(填“极性”或“非极性”)分子。
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是键。
(3)就物理性质而言,第二周期原子序数最小的元素的单质是最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式:。
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是。
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
6-羰基庚酸是一种重要的化工中间体,下面合成它的流程图:
已知: 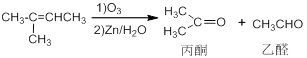
(1)反应①的条件是,反应类型是。
(2)下列说法中正确的是:
a.1molC与足量的Na反应生成1molH2 b.C能被催化氧化成酮
c.Ni催化下1molG最多只能与1molH2加成 d.F能发生消去反应生成两种不同烯烃
(3)E与新制Cu(OH)2反应的化学方程式为。
(4)G的同分异构体有多种。请写出结构中含有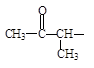 、且属于酯类的同分异构
、且属于酯类的同分异构
体:、、。
(5)已知“Diels-Alder反应”为: 。,
。,
物质D与呋喃(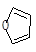 )也可以发生“Diels-Alder反应”,该化学反应方程式为:
)也可以发生“Diels-Alder反应”,该化学反应方程式为:
。
已知:有机物D(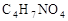 )是组成人体蛋白质的氨基酸之一,它可由A通过以下反应合成制取。有机物A(
)是组成人体蛋白质的氨基酸之一,它可由A通过以下反应合成制取。有机物A(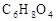 )为食品包装中的常用防腐剂,常温下难溶于水, 可以使溴水褪色。有机物B(
)为食品包装中的常用防腐剂,常温下难溶于水, 可以使溴水褪色。有机物B(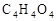 ),其分子中没有支链,通常状况下为无色晶体,能与氢氧化钠溶液发生反应。
),其分子中没有支链,通常状况下为无色晶体,能与氢氧化钠溶液发生反应。
请回答下列问题: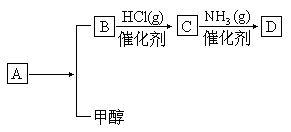
(1)B、D的结构简式分别是______________________、__________________________。
(2)A可以发生的反应有__________(选填序号)
①加成反应②氧化反应③酯化反应④加聚反应
(3)B分子中所含的官能团名称是______________________________。
(4)B的具有相同官能团的同分异构体的结构简式是______________________________。
(5)写出由B与甲醇反应制A的化学方程式是____________________________________。
___________________________________________________________。
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1m2 ( 选填“<”、“=”、“>”)
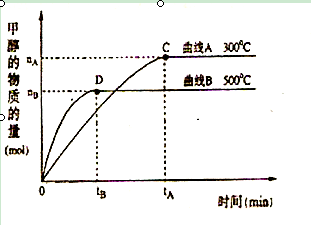
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值(填“增大”、“减小”或“不变”)。在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)常温下,某纯碱溶液中滴入酚酞,溶液呈红色。说明该溶液呈性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)。
已知33As、35Br位于同一周期。某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是。已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式是。
(2)在该反应条件下可推知(填序号)。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(3)该反应的氧化剂和还原剂的物质的量之比为__________; KBrO3与HBr反应也会生成X,则该反应中氧化剂和还原剂的物质的量之比为__________。