有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
A的单质是密度最小的物质 |
| B |
B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C |
C的原子最外层电子数是其内层电子数的三倍 |
| D |
D与B同周期,该周期中D的简单离子半径最小 |
| E |
B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F |
F元素最高正价与最低负价的代数和为4 |
(1)写出化合物Y所含的化学键名称 ;
(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示) ;
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式
;
(4)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中D单质的质量分数为 ;
(5)一定量的石灰乳中通人一定量的E单质。两者恰好完全反应,生成物中有三种含E元素的离子.其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。则t2时刻消耗氢氧化钙质量为 g,此时反应的化学方程式为 。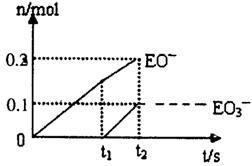
(6)A、B形成的化合物BA在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的钠化合物。写出它与乙醇反应的化学方程式 。
根据所学知识回答下列问题,在如图所示装置中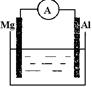 ,
,
(1)若烧杯中溶液为稀硫酸,则观察到的现象为 ,正极反应式为,负极反应式为,
该装置中的能量变化形式为。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为。
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为。D在周期表中位置 。
(2)写出E的电子式:。
(3)A、D两元素形成的化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:。
(1)下列物质中:互为同素异形体的有(填序号,下同),属于同位素的有,属于同一种物质的有。
①液氯 ② Cl③白磷 ④氯气 ⑤红磷 ⑥
Cl③白磷 ④氯气 ⑤红磷 ⑥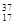 Cl
Cl
(2)下列物质中:只存在共价键的是(填序号,下同),只存在离子键的是,既存在离子键又存在极性共价键的是,既存在离子键又存在非极性共价键的是。
①Ar ②CO2 ③Na2O2 ④KOH ⑤MgBr2⑥NH4Cl⑦CaO ⑧H2SO4
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是______________;
(2)X与金属钠反应放出氢气,反应的化学方程式是_____________________
(3)X与空气中的氧气在铜或银催化下反应生成Y的方程式________________;(3分)
Y能被新制的氢氧化铜氧化。其反应方程式为:______________________
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率。(要求写出计算过程)
(1)有机物CH3CH(C2H5)CH(CH3)2的系统命名法名称是__________________
(2)有机物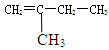 和Br2发生加成反应时,产物的结构简式为
和Br2发生加成反应时,产物的结构简式为